
M. LEMOINE,
Hôpital Jean-Verdier, Bondy
L’infection chronique par le virus de l’hépatite C (VHC) touche environ 30 % des patients infectés par le VIH chez qui elle représente désormais une des principales causes de morbidité et de mortalité. Avec pour principal objectif l’éradication du VHC, la prise en charge thérapeutique de la co-infection VIH-VHC est complexe. Elle doit tenir compte du risque de toxicité hépatique, des interactions et des effets secondaires des traitements dans un contexte d’immunosuppression parfois sévère.
Épidémiologie
Parmi les 38,6 millions de personnes infectées dans le monde par
le VIH, l’ONUSIDA estime que 11 millions le sont aussi par un virus
des hépatites dont 4 à 5 millions par le VHC. Cette forte
prévalence s’explique par des modes de contamination communs aux
deux virus et par une augmentation du risque de transmission du VHC
chez les patients porteurs du VIH avec un faible taux de guérison
spontanée de l’hépatite aiguë chez ces malades (5 à 10 % chez les
patients infectés par le VIH contre 20 à 30 % chez les
non-infectés). En France, la prévalence de l’infection par le VHC
est de 0,86 % dans la population générale, alors qu’elle est de
24,3 % chez les patients infectés par le VIH pouvant atteindre 90 %
parmi les usagers de drogues intraveineuses.
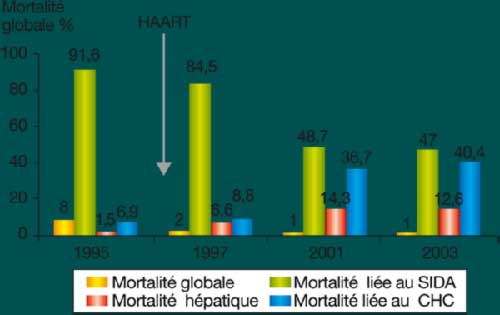
Depuis 1996, l’efficacité des traitements antirétroviraux hautement
actifs (HAART) a considérablement modifié l’histoire naturelle de
l’infection par le VIH. La mortalité liée au SIDA a nettement
diminué, alors que les hépatites virales et leurs complications
sont devenues la principale cause de morbidité et de mortalité chez
les patients infectés par le VIH. Les études françaises
multicentriques Germevic et Mortavic, menées dans de larges
cohortes de patients infectés par le VIH, ont montré une
augmentation significative de la mortalité hépatique entre 1995 et
2001 (respectivement 1,5 % et 14,3 %) avec un taux de décès lié à
au carcinome hépatocellulaire de 36,7 % en 2001 contre 6,9 % en
1995(1,2) (figure 1).
 |
|
Figure 1. |
Histoire naturelle
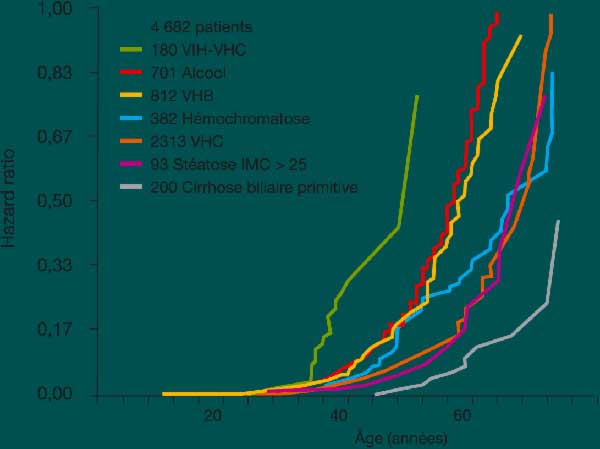
Chez les patients co-infectés VIH-VHC, la mortalité est significativement plus élevée que chez les mono-infectés. Cette surmortalité est liée à un effet délétère du VIH sur la progression de l’infection par le VHC. Alors que l’effet du VHC sur le VIH reste controversé, il est actuellement bien établi que le VIH accélère l’histoire naturelle de l’infection par le VHC. Chez les patients infectés par le VIH, les niveaux de charges virales du VHC sont plus élevés, la vitesse de progression de la fibrose hépatique est accélérée (figure 2) et le risque d’hépatocarcinome plus important. Le délai moyen de survenue de cirrhose chez les co-infectés est estimé à 15 ans contre 30 ans chez les patients mono-infectés VHC(3).
 |
|
Figure 2 : |
Une métaanalyse portant sur 1 871 mono-infectés par le VHC et 601
co-infectés a trouvé un risque relatif de cirrhose de 2,92 chez les
sujets co-infectés comparés aux mono-infectés VHC(4).
Chez les patients
co-infectés VIH-VHC, la mortalité est significativement
plus élevée que chez les mono-infectés.
| Facteurs de risque de progression de la fibrose chez les patients co-infectés VIH-VHC |
|---|
| • âge > 40 ans • Consommation excessive d’alcool/injection de drogues intraveineuses • Surpoids • Déficit immunitaire (CD4 < 200/mm3) • Co-infection par les virus de l’hépatite B ± D |
| Facteurs prédictifs de bonne réponse à la bithérapie anti-VHC chez les patients VIH+ |
|---|
| • Charge virale initiale faible • Charge virale négative à S12 • Bonne observance • Durée du traitement et posologie optimales |
Évaluer précocement le degré de fibrose
L’évolution rapide de la fibrose hépatique au cours de la
co-infection VIH-VHC justifie une évaluation précoce des lésions
histologiques. Les transaminases seules ne permettent pas d’évaluer
le degré de fibrose et de poser l’indication d’un traitement
antiviral. La biopsie hépatique reste l’examen de référence pour
quantifier
l’atteinte hépatique chez ces patients. Cependant, le développement
de méthodes non-invasives pourrait permettre d’améliorer le
dépistage des lésions hépatiques sévères. L’élastométrie
(Fibroscan‚), mesure non-invasive de la fibrose hépatique, testée
chez 72 patients co-infectés VIH-VHC est une méthode
prometteuse(5). Une étude récente a également proposé l’utilisation
d’un modèle simple, FIB-4, prenant en compte l’âge, les
transaminases et les plaquettes pour évaluer le niveau de fibrose
chez des malades co-infectés VIH-VHC(6).
Traitement
L’objectif principal du traitement est l’éradication complète du
VHC permettant de contrôler la progression de la fibrose et de
prévenir l’insuffisance terminale hépatique. Le traitement du VHC
doit être discuté chez tous les patients co-infectés en considérant
leur degré d’immunosuppression.
En l’absence d’indication d’un traitement antirétroviral (CD4 >
350/mm3), la stratégie repose sur l’éradication du VHC. Le
traitement des deux virus peut se faire de façon concomitante si
les cd4 sont supérieurs à 200/mm3. En cas d’immunosuppression
sévère (CD4 < 200/mm3), une restauration immunitaire préalable
doit être envisagée par un traitement antirétroviral qui doit tenir
compte de ses effets secondaires, en particulier hépatiques, et de
ses interactions avec la bithérapie pégylée. Chez les sujets
co-infectés VIH-VHC, plusieurs études ont estimé entre 12 et 14 %
le risque d’hépatotoxicité sévère (grade 3 ou 4) liée aux
antirétroviraux. Certaines molécules doivent être proscrites : la
didanosine (ddI, Videx‚) et la stavudine (d4T, Zérit‚) qui peuvent
induire une toxicité mitochondriale et une stéatose
microvésiculaire, mais aussi la névirapine (Viramune‚), associée à
un risque d’hépatotoxicité sévère de 5 % et d’hépatite fulminante.
La zidovudine (AZT, Rétrovir‚), doit être évitée, surtout en
association à la ribavirine compte tenu du double risque
d’anémie.
Plusieurs études ont estimé entre 12 et 14 % le risque d’hépatotoxicité sévère (grade 3 ou 4) lié aux antirétroviraux.
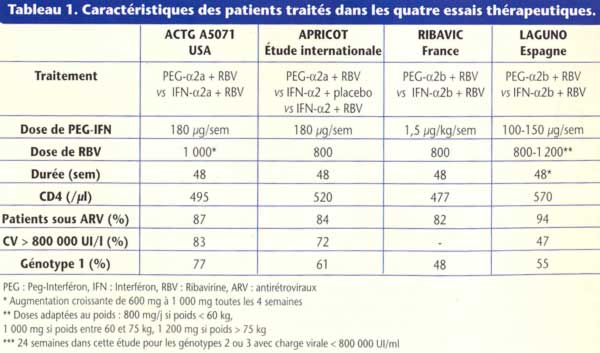
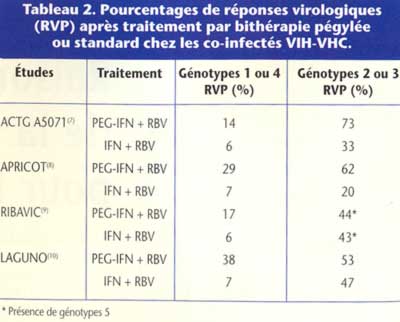
L’éradication du VHC repose sur la bithérapie pégylée, prescrite aux mêmes doses que chez le sujet mono-infecté, mais pour une durée de 48 semaines. Quatre essais thérapeutiques (l’étude américaine ACTG A5071, l’étude internationale APRICOT, l’étude française RIBAVIC et l’étude espagnole LAGUNO [tableau 1]) ont permis de démontrer les bénéfices de la bithérapie pégylée sur la bithérapie standard, avec un taux de réponses virologiques prolongées variant de 27 à 44 % contre 12 à 21 %, tous génotypes confondus (tableau 2)(7-10).
Les génotypes 2,3 ont des chances de guérison supérieures à 50 % avec la bithérapie pégylée, alors que pour les génotypes 1,4, le pourcentage de réponse virologique prolongée varie entre 14 et 38 % selon les études (figure 3).
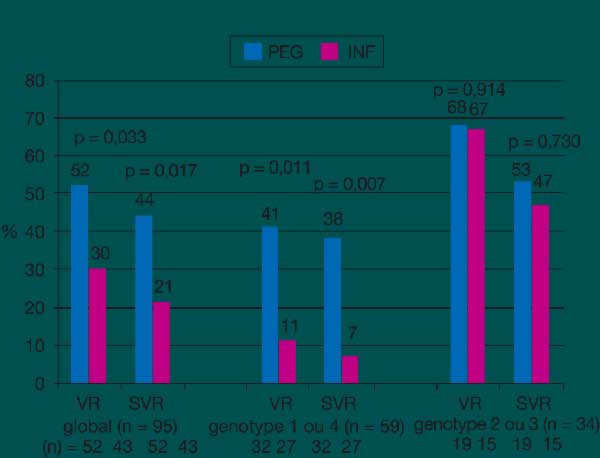 |
|
Figure 3. |
Une charge virale négative à la 12e semaine de traitement est
associée à 70 % de chances de réponse virologique prolongée et,
comme pour le sujet mono-infecté, elle justifiera l’arrêt du
traitement en
l’absence de baisse significative (> 2 log). Le traitement doit
être, au mieux, maintenu à pleines doses pendant toute la durée
préconisée en ayant recours aux facteurs de croissance
hématopoïétiques en cas de cytopénie sévère. L’accompagnement des
effets secondaires liés à la bithérapie permet non seulement de ne
pas réduire la posologie recommandée, gage d’une efficacité
virologique, mais aussi d’améliorer la qualité de vie des patients
durant le traitement et d’optimiser ainsi leur adhérence.
La conférence de consensus recommande de traiter les patients ayant
des lésions de fibrose significative (Ž F2) et/ou une activité
importante (Ž 2). Cependant, compte tenu de l’évolution rapide de
la fibrose hépatique chez les patients co-infectés, il semble
légitime d’envisager un traitement antiviral même pour des lésions
modérées (F1), en particulier s’il s’agit d’un malade compliant,
porteur d’un génotype 2 ou 3. La cirrhose décompensée reste une
contre-indication à la bithérapie pégylée chez le patient
co-infecté.
Place de la transplantation hépatique
L’infection par le VIH a été pendant longtemps une
contre-indication à la transplantation hépatique (TH) avec, pour
principales raisons, un pronostic défavorable de la maladie et une
crainte
d’effets délétères du traitement immunosuppresseur sur la
progression de l’infection par le VIH. Désormais, grâce à
l’efficacité des trithérapies antirétrovirales, la TH n’est non
seulement plus une contre-indication mais un traitement qu’il faut
savoir envisager précocement avec la participation d’équipes
entraînées. La littérature médicale ne dispose actuellement que de
petites séries de TH totalisant environ 200 malades. Elles ont été
réalisées majoritairement pour cirrhose décompensée, chez des
malades très sélectionnés, dont l’infection VIH était bien
contrôlée par la HAART.
La TH n’est non seulement plus une contre-indication, mais un traitement qu’il faut savoir envisager précocement.
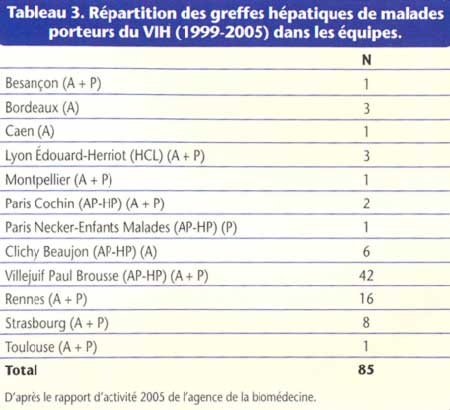
En France, le nombre de malades co-infectés ayant bénéficié d’une greffe reste limité : 85 entre 1999 et 2005 d’après le rapport de l’agence de la biomédecine (tableau 3).
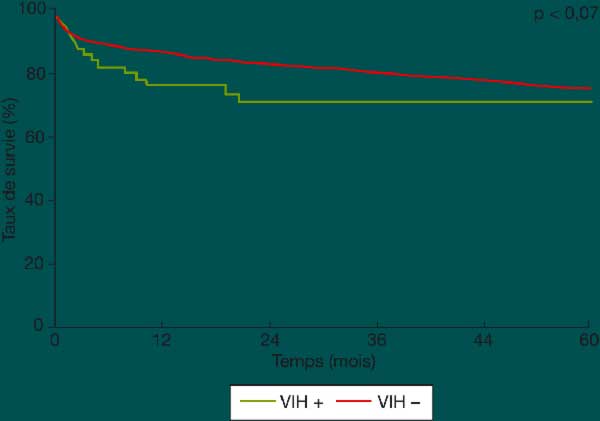
La TH ne semble pas aggraver l’infection par le VIH. L’incidence des rejets aigus, des infections et des cancers n’apparaît pas supérieure chez les transplantés hépatiques infectés par le VIH comparés à ceux mono-infectés par le VHC. Cependant, une étude récemment publiée, retrouvait en post-TH, 44 % de rejets aigus chez 9 patients co-infectés, contre 22 % dans le groupe de patients mono-infectés(11). Dans cette même étude, l’incidence des infections en post-TH n’était pas supérieure chez les patients co-infectés comparés aux mono-infectés et la survie à 3 ans n’était pas différente entre les deux groupes : 87,5 % chez les patients co-infectés versus 93,7 % chez les mono-infectés. Ce dernier résultat s’accorde avec celui rapporté par l’agence de la biomédecine en 2005 : la survie à 5 ans après TH, quelle qu’en soit l’indication, est de 70 % chez les patients infectés par le VIH contre 74 % chez les non-infectés VIH (figure 4).
 |
|
Figure 4 : |
Le principal problème observé en post-TH chez les sujets
infectés par le VHC est la récidive précoce de l’infection par le
VHC qui concerne tous les malades et qui semble plus sévère et plus
précoce au cours de la co-infection.
D’après les experts, les conditions requises avant TH chez les
malades infectés par le VIH sont :
– un contrôle de la réplication virale du VIH (charge virale <
40 copies/ml) ;
– une immunité correcte sans valeur précisément définie du taux de
CD4 (au minimum supérieur à 100/mm3, au mieux supérieur à 250/mm3)
;
– l’absence d’antécédent de maladies opportunistes classantes SIDA.
Les indications restent les mêmes que pour les patients
non-infectés par le VIH.
Néanmoins, en raison d’une évolution rapide de la maladie, la TH
doit être envisagée avant la première décompensation
hépatique.
La TH est donc faisable avec des résultats presque similaires aux
mono-infectés en termes de survie qui nécessitent d’être confirmés
à plus long terme.
Cas particulier de la surinfection aiguë par le VHC
Chez les patients VIH, les chances de guérison spontanée après infection aiguë par le VHC sont faibles. En cas d’absence d’élimination virale à 3 mois, évaluée par une mesure de l’ARN viral, il est recommandé de traiter les patients infectés par le VIH. Le choix d’une monothérapie ou d’une bithérapie pégylées est encore discuté. La durée proposée est de 6 mois. Un tel traitement permettrait d’obtenir une réponse virologique prolongée élevée (atteignant 70 % selon les études), cependant inférieure à celle observée en l’absence de co-infection par le VIH(12).
Conclusion
Touchant le plus souvent une population fragile et marginalisée, la co-infection VIH-VHC est une maladie fréquente et grave compte tenu d’une progression rapide vers la cirrhose et d’un risque élevé d’hépatocarcinome. Ainsi, elle nécessite une prise en charge précoce dont l’un des objectifs principaux est l’éradication du VHC sous couvert d’une immunité correcte, par un traitement antirétroviral bien choisi. Cet objectif peut être atteint, non seulement grâce à la bithérapie pégylée qui a prouvé sa faisabilité et son efficacité chez ces patients, mais aussi grâce aux facteurs de croissance permettant la correction des effets secondaires liés à la bithérapie. Le développement de nouvelles molécules pour le traitement du VHC (antiprotéases) et les progrès de la transplantation hépatique laissent espérer une amélioration de la survie chez ces malades.
Références
1. Cacoub P, Geffray L, Rosenthal E et al. Mortality among
HIV-infected patients with cirrhosis or hepatocellular carcinoma
due to hepatitis virus C in French departments of Internal
Medecine/Infectious Diseases in 1995 and 1997. Clin Infect Dis 2001
: 32 : 1207-14.
2. Rosenthal E, Poiree M, Pradier C et al. Mortality due to
hepatitis C-related liver disease in HIV-infected patients in
France. AIDS 2003 ; 17 : 1803-9.
3. Benhamou Y, Bochet M, Di Martino V et al. Liver fibrosis
progression in HIV-HCV co-infected patients. The Multivirc group.
Hepatology 1999 ; 30(4) :1054-8.
4. Graham CS, Baden LR, Yu E et al. Influence of HIV infection on
the course of hepatitis C virus infection: a meta-analysis. Clin
Infect Dis 2001 ; 33 : 562-9.
5. De Lédinghen V, Rouvin C, Kettaneh A et al. Diagnosis of hepatic
fibrosis and cirrhosis by transient elastography in
HIV/HCV-coinfected patients. J Acqui Immune Defic Syndr 2006 ; 41 :
175-9.
6. Sterling R, Lissen E, Clumeck N et al. Development of a simple
non-invasive index to predict significant fibrosis in patients with
HIV/HCV coinfection. Hepatology 2006 ; 43 (6) : 1317-25.
7. Chung RT, Anderson J, Volberding P et al. Peginterferon alfa-2a
plus ribavirin versus interferon alfa-2a plus ribavirin in chronic
hepatitis C in HIV-coinfected persons. N Engl J Med 2004 ; 351 :
451-9.
8. Torriani FJ, Rodriguez-Torres M, Rockstroh JK et al.
Peginterferon alfa-2a plus ribavirin for chronic hepatitis C in
HIV-infected patients. N Engl J Med 2004 ; 351 : 438-50.
9. Carrat F, Bani-Sadr F, Pol S et al. Peginterferon alfa-2b vs
standard interferon-2b, plus ribavirin, for chronic hepatitis C in
HIV-infected persons. JAMA 2004 ; 292 : 2839-48.
10. Laguno M, Murillas J, Blanco JL et al. Peginterferon alfa-2b
plus ribavirin compared with interferon alfa-2b plus ribavirin for
the treatment of HIV-HCV co infected patients. AIDS 2004 ; 18 :
F27-F36.
11. Castells L, Escartin A, Bilbao I et al. Liver Transplantation
in HIV-HCV coinfected patients: a case control study.
Transplantation 2007 ; 83 : 354-8.
12. Dominguez S, Ghosn J, Valantin MA et al. Efficacy of early
treatment of acute hepatitis C infection with pegylated interferon
and ribavirin in HIV infected patients. AIDS 2006 ; 20 :
1157-61.




