Dieter G. Mortier, Christel Meuleman, Thomas D’Hooghe
Service de Gynécologie-Obstétrique, Centre Universitaire Louvaniste
de la Fertilité, UZ Leuven, KUL
Une douleur dans le bas-ventre est un symptôme fréquent chez les adolescentes. L’une des causes possibles est l’endométriose. Dans cet article, nous voulons donner une vue d’ensemble de la prévalence, de la pathogenèse et des manifestations cliniques de l’endométriose chez les adolescentes. En outre, nous traiterons de l’importance d’une bonne anamnèse, de l’examen clinique et des moyens diagnostiques supplémentaires. Nous nous concentrerons aussi sur les approches thérapeutiques possibles. Enfin, nous voulons proposer un schéma pour la prise en charge diagnostique et thérapeutique d’une adolescente présentant une douleur pelvienne suggérant une endométriose.
Introduction
Le terme ‘endométriose’ désigne la présence de tubes glandulaires et de stroma endométriaux en dehors de la cavité utérine, y compris du myomètre. Cet endomètre ectopique se trouve principalement dans le petit bassin, mais il peut être présent à n’importe quel endroit du corps. L’affection peut être aussi bien asymptomatique que symptomatique. Malgré de nombreuses études, il subsiste beaucoup de controverses concernant son incidence, sa pathogenèse, son évolution et son traitement optimal.
Prévalence/incidence
On ne connaît pas la prévalence de l’affection dans la population générale. Les estimations varient en fonction de la population étudiée (symptomatique versus asymptomatique) et des méthodes de diagnostic (clinique versus chirurgical). Dans une seule étude, on a retrouvé une endométriose chez 1% de l’ensemble des femmes en âge de procréer qui avaient subi une intervention chirurgicale pour n’importe quelle indication gynécologique, et chez 12 à 32% des femmes en âge de procréer qui avaient subi une laparoscopie en raison d’une douleur pelvienne. On estime que 4 à 17% des femmes en période postménarchale ont de l’endométriose (2). En ce qui concerne spécifiquement l’endométriose chez les adolescentes, il existe des études qui démontrent que 25 à 38% des adolescentes présentant une douleur pelvienne chronique ont de l’endométriose (3, 4). Cette prévalence augmente jusqu’à 50 à 70% chez les adolescentes présentant une douleur pelvienne qui n’a pu être contrôlée par des contraceptifs oraux (CO) ou des anti-inflammatoires non stéroïdiens (AINS) (5-7). Bien qu’on ait supposé par le passé que l’endométriose ne se manifestait qu’après quelques années de menstruation, il existe des articles qui ont décrit une endométriose avant la ménarche (8), 1 mois (9) et 5 mois après la ménarche (10).
Pathogenèse
Certaines adolescentes peuvent avoir une prédisposition génétique pour le développement de l’endométriose. Dans une étude, on a observé une endométriose chez 7% des parentes au premier degré de patientes endométriosiques contre seulement 1% des parentes d’un groupe témoin (11). Il existe différentes théories en ce qui concerne la pathogenèse exacte, mais aucune ne peut expliquer tous les cas d’endométriose. La théorie de l’implantation ou de la menstruation rétrograde de Sampson stipule que, pendant la menstruation, du tissu endométrial est transporté à travers les trompes et peut ainsi s’implanter dans la cavité péritonéale (12). Cette théorie est étayée par le fait que l’endométriose s’observe le plus dans les parties déclives du pelvis. En outre, il existe des anomalies obstructives du tractus génital féminin qui s’accompagnent d’une menstruation rétrograde accrue et qui sont associées à une endométriose chez l’adolescente (9, 13, 14). Schifrin et al ont identifié six adolescentes présentant des anomalies müllériennes associées à une endométriose. La plus jeune patiente était une jeune fille de 12 ans avec atrésie vaginale et utérus bicorne associé à un hématocolpos (13). On a même observé une guérison de l’endométriose après rétablissement d’une anomalie obstructive (14). Il existe encore d’autres théories. La présence d’une endométriose dans des localisations extrapelviennes telles que le poumon, le cerveau et la peau s’explique par une propagation intravasale de cellules endométriales, soit par voie lymphogène, soit par voie vasculaire (15). La théorie de la métaplasie coelomique stipule que la cavité coelomique (cavité péritonéale) contient des cellules indifférenciées ou des cellules qui peuvent se différencier en tissu endométrial. La théorie de la transplantation directe est une explication possible pour la présence d’endométriose dans les cicatrices d’une épisiotomie, d’une césarienne… La théorie la plus récente part d’un trouble immunitaire: une anomalie de l’immunité cellulaire donnerait à du tissu endométrial ectopique la possibilité de proliférer (16-18). On pense également que des facteurs environnementaux peuvent influencer le développement d’une endométriose. Toutes ces théories aident à expliquer certains aspects de l’endométriose. Aucune n’arrive cependant à expliquer tous les cas d’endométriose, en particulier lorsque nous regardons les adolescentes. L’endométriose postpubertaire/ préménarchale constitue dès lors un défi (8). La cause est très vraisemblablement multifactorielle et tous les mécanismes proposés peuvent contribuer à l’étiologie du processus morbide.
Manifestations cliniques et premier examen
Les adolescentes peuvent consulter pour une douleur pelvienne acyclique aussi bien que cyclique, contrairement aux femmes adultes qui consultent classiquement pour une douleur cyclique (7). D’autres symptômes souvent présents sont une dysménorrhée, des saignements anormaux accompagnés d’une douleur à type de crampe et une dyspareunie profonde. Des symptômes vésicaux comme la dysurie, l’urgence mictionnelle, l’hématurie et des symptômes gastro-intestinaux tels que douleur abdominale, nausées, diarrhée et constipation, douleur rectale, hémorragie rectale, dyschésie cyclique, peuvent également se produire (6, 7). Les symptômes douloureux sont souvent suffisamment sévères pour avoir des implications sociales comme l’absentéisme scolaire et l’incapacité d’exercer d’autres activités. Un point important est que les adolescentes consultent rarement avec la triade classique dysménorrhée - dyspareunie - infertilité. On enregistre une incidence élevée d’endométriose chez les adolescentes présentant une douleur cyclique, en particulier lorsque cette douleur irradie vers le dos ou les membres inférieurs, ou lorsqu’elle s’accompagne de symptômes gastro-intestinaux (6, 19). Les endométriomes ovariens sont rares avant l’âge de 25 ans (19). Une vue d’ensemble est présentée au tableau 1 (20).
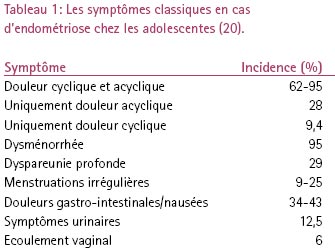 |
Le fait de reconnaître ces symptômes à temps peut raccourcir l’intervalle entre le début de ceux-ci et la présentation des signes, et l’intervalle entre la présentation des signes et le diagnostic. Idéalement, un diagnostic précoce de l’endométriose améliorera les effets à long terme (douleur chronique, endométriomes et infertilité) et par conséquent la qualité de vie des adolescentes et des femmes adultes. Cela doit cependant encore être prouvé par des études prospectives. Chez une adolescente présentant une douleur pelvienne, la première évaluation doit partir d’une anamnèse approfondie. Un agenda de la douleur peut ici s’avérer utile. L’examen clinique est important, mais il ne peut pas toujours se faire chez toutes les adolescentes (vierges). Le but de l’examen est de rechercher l’étiologie de la douleur et aussi d’exclure des tumeurs ovariennes et des anomalies du tractus génital. Pour les adolescentes non sexuellement actives, un examen recto-abdominal peut être plus acceptable qu’un examen vagino-abdominal. Un test du Q-tip (introduction d’un bâtonnet ouaté dans le vagin) peut s’utiliser pour exclure des anomalies obstructives ou partiellement obstructives telles qu’un septum vaginal, un hymen imperforé ou microperforé, un hémivagin occlus (19). A un stade précoce du processus morbide, il arrive souvent que l’examen pelvien ne révèle pas d’anomalies. Les résultats peuvent varier d’une sensibilité pelvienne normale à une sensibilité généralisée. Occasionnellement, on palpe parfois une masse annexielle, mais les endométriomes sont rares chez les femmes de moins de 20 ans. L’examen recto-vaginal peut parfois mettre en évidence une sensibilité focale au niveau du cul-de-sac de Douglas ou des nodularités dans les ligaments utéro-sacrés (20). Sur le plan de l’imagerie, un examen échographique complète l’examen clinique limité. Cette échographie sert à exclure des masses pelviennes (endométriomes rares, kystes ovariens, torsion, tumeurs) ou des anomalies structurelles (19). Il va de soi qu’il s’agit chez les vierges d’une échographie transabdominale avec vessie remplie.
La tomodensitométrie (TDM) peut aider à exclure une appendicite dans les cas de douleur aiguë; dans d’autres cas, elle est de peu d’utilité (19). L’IRM (imagerie par résonance magnétique) est très utile pour évaluer les anomalies génitales. Compte tenu du coût de cet examen, il ne doit être demandé que lorsqu’il y a une suspicion clinique ou échographique suffisante (20). En ce qui concerne le diagnostic complémentaire, on peut aussi pratiquer des tests de laboratoire. Cela peut être important pour exclure d’autres affections. Un test sanguin complet avec formule sanguine, CRP et vitesse de sédimentation peut aider à exclure un processus inflammatoire aigu ou chronique. Par ailleurs, une analyse et une culture d’urine peuvent être indiquées pour exclure une cause urinaire de la douleur (calculs, cystite…). Lorsque la patiente est sexuellement active, il faut pratiquer un test de grossesse en plus des tests pour les maladies sexuellement transmissibles (MST) telles que la chlamydiase et la gonorrhée. Chez les patientes avec endométriose connue, on peut utiliser le CA-125 pour le suivi de la progression de la maladie. Cette détermination n’est cependant pas utile comme test de dépistage, en raison du grand nombre de faux positifs (19). Nous préférons un suivi clinique des symptômes et nous n’utilisons dès lors pas le CA-125.
Premier traitement - Traitement empirique
Une intervention médicale est indiquée, même s’il n’y a pas encore de diagnostic histologique, chez les adolescentes qui présentent une perturbation des activités normales en raison de la douleur. Le traitement de la dysménorrhée doit être la première étape chez les adolescentes présentant une douleur gynécologique non aiguë. L’ACOG (American College of Gynaecologists and Obstetricians) recommande un traitement d’essai de trois mois avec des AINS et un CO faiblement dosé (21). Il est conseillé de commencer les AINS avant la survenue de la douleur prévue. C’est lorsqu’il est instauré 1 à 2 jours avant la menstruation prévue que le traitement est le plus efficace (22). Les CO peuvent être pris de manière continue pour éviter une dysménorrhée. Une pilule monophasique à 30 ou 35 microgrammes est plus efficace que les pilules triphasiques plus faiblement dosées. En outre, il y a moins de risque d’hémorragie perthérapeutique (20). De plus, d’autres avantages sont encore liés à l’utilisation de CO: ils sont sûrs pour les adolescentes et induisent une atténuation de l’acné et une protection contre une grossesse non désirée (22). Les CO sont donc certainement utiles chez les adolescentes qui ont en outre besoin d’une contraception. Parfois, les parents peuvent avoir une objection à l’utilisation de CO comme traitement empirique, parce que, selon leur expérience, cela abaisserait le seuil vis-à-vis des relations sexuelles. Lors du conseil, les autres aspects doivent être soulignés. En alternative aux CO, on peut utiliser le patch contraceptif ou l’anneau vaginal. Les CO réduisent la dysménorrhée en limitant la croissance de l’endomètre, limitant ainsi la quantité de tissu endométrial susceptible de produire des prostaglandines et des leucotriènes. En outre, les CO inhibent l’ovulation et la production de progestérone qui s’ensuit, et ils induisent une inhibition et une inactivation temporaires des lésions endométriosiques (22). Un essai empirique avec des agonistes de la GnRH (gonadolibérine) avant l’âge de 18 ans n’est pas conseillé par l’ACOG, compte tenu des effets indésirables possibles de ce traitement (21). Ces médicaments induisent un état d’hypo-estrogénisme, ce qui pose question concernant le métabolisme osseux. De plus, des effets indésirables tels que bouffées de chaleur, labilité émotionnelle et céphalées peuvent se produire (22), ce qui est difficile à accepter d’un traitement empirique.
Echec du traitement empirique
Chez les patientes chez lesquelles la douleur persiste après trois mois de traitement d’essai, une évaluation supplémentaire est indiquée dans le cadre de l’endométriose. Une laparoscopie est indispensable pour diagnostiquer l’endométriose, c’est l’examen de référence. Cette procédure peut être réalisée en toute sécurité chez l’adolescente. Les gynécologues qui pratiquent une laparoscopie chez des adolescentes présentant une douleur pelvienne doivent être familiarisés avec les lésions atypiques de l’endométriose chez les adolescentes, lésions qui sont plutôt rouges, claires ou blanches, contrairement aux lésions chocolat des adultes (21). La meilleure classification du degré d’endométriose est la Revised American Society of Reproductive Medicine Classification of Endometriosis (19, 21, 23). Chez les adolescentes, il est important de tenir compte du résultat cosmétique lorsqu’on pratique des incisions pendant l’intervention. Au moment de la laparoscopie diagnostique, on doit pouvoir réaliser simultanément un traitement chirurgical, pour éviter que la patiente ne doive inutilement subir deux opérations différentes sous anesthésie générale (19). L’ablation des lésions par électrochirurgie ou laser, ou résection de l’endométriose, se pratique donc de préférence au moment de la laparoscopie diagnostique (24). Le but du traitement chez l’adolescente est la répression de la douleur, la prévention de la progression de l’endométriose et la préservation de la fertilité, comme cela est expliqué à la figure 1. Une approche globale, tenant compte de la prévention de la douleur, de l’infertilité et de la rechute de l’endométriose sera de préférence définie dès le moment du diagnostic et jusqu’à ce que le désir d’enfant ait été satisfait (21). Les détails relatifs à ce traitement médicamenteux poursuivi sont brièvement résumés à la figure 1 et n’entrent pas dans le cadre de cet article.
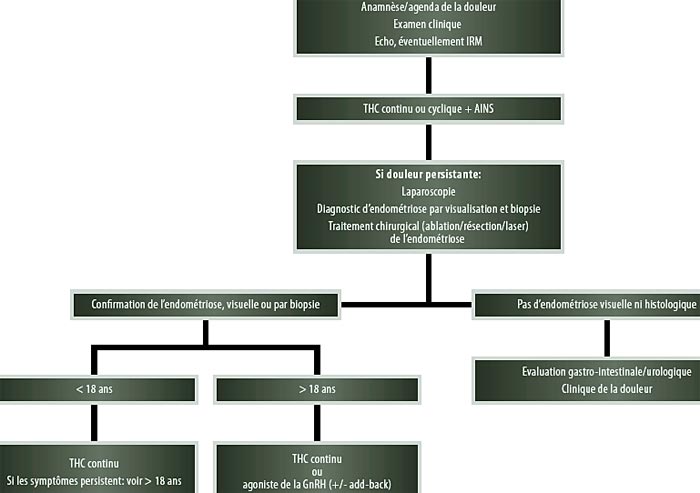 |
|
Figure 1. |
Conclusion
La prévalence et l’incidence de l’endométriose chez les adolescentes ne sont pas connues jusqu’à présent. Un certain nombre de données de la littérature à ce sujet ont néanmoins été présentées. Il existe plusieurs théories en ce qui concerne la pathogenèse de cette affection, qui ne peuvent cependant pas expliquer tous les cas d’endométriose. La cause est vraisemblablement multifactorielle. Chez les adolescentes, la manifestation clinique peut être très différente et, contrairement à ce qui se passe chez les adultes, les plaintes peuvent être aussi bien cycliques qu’acycliques. Il est important de reconnaître ces symptômes à temps. On a traité de l’importance de l’examen clinique et de quelques examens techniques complémentaires éventuels. Chez les adolescentes présentant une douleur gynécologique non aiguë, un traitement d’essai avec des AINS ou un CO est conseillé. Si les symptômes persistent après trois mois de traitement d’essai, il faut pratiquer une laparoscopie diagnostique et, si nécessaire, simultanément thérapeutique. Si l’endométriose est confirmée, un traitement médicamenteux ultérieur est indiqué pour prévenir la récidive ou du moins la retarder.
Références
1. Sangi-Haghpeykar H, Poindexter AN. Epidemiology of
endometriosis among parous women. Obestet Gynecol
1995;85:983.
2. Ranney B. Etiology, prevention and inhibition of endometriosis.
Clin Obstet Gynecol 1980;23:875.
3. Vercellini P, Fedele L, Arcaini L. Laparoscopy in the diagnosis
of chronic pelvic pain in adolescent women. J Reprod Med
1989;34:827.
4. Kontoravdis A, Hassan E, Hassiakos D. Laparoscopic evaluation
and management of chronic pelvic pain during adolescence. Clin Exp
Obstet Gynecol 1999;26:76.
5. Laufer MR, Goldstein DP: Dysmenorrhea, pelvic pain and the
premenstrual syndrome. Pediatric and Adolescent Gynecology (4th
ed.). Edited by Emans SJ, Laufer MR, Goldstein DP. Philadelphia,
Lippincott, Williams & Wilkins Publishing Company, 1998:
363-410.
6. Reese KA, Reddy S, Rock JA. Endometriosis in an adolescent
population: The Emory experience. J Pediatr Adolesc Gynecol
1996;9:125.
7. Laufer MR, Goitein L, Bush M, Cramer DW, Emans SJ. Prevalence of
endometriosis in adolescent women with chronic pelvic pain not
responding to conventional therapy. J Pediatr Adolesc Gynecol
1997;10:199.
8. Laufer MR. Premenarcheal endometriosis without an associated
obstructive anomaly: Presentation, diagnosis, and treatment. Fertil
Steril 2000;74:S15.
9. Goldstein DP, De Cholnoky C, Leventhal JM, Emans SJ: New
insights into the old problem of chronic pelvic pain. J Ped Surg
1979;14:675.
10. Yamamoto K, Mitshuhashi Y, Takaike T. Tubal endometriosis
diagnosed within one month after menarche: a case report. Tohoko J
Exp Med 1997;181:385.
11. Simpson JL, Elias S, Malinak LR, Buttram VC. Heritable aspects
of endometriosis. Am J Obstet Gynecol 1980;137:327.
12. Sampson JA. Peritoneal endometriosis due to the menstrual
dissemination of endometrial tissue into the peritoneal cavity. Am
J Obstet Gynecol 1927;14:422. 13. Schifrin BS, Erez S, Moore JG.
Teen-age endometriosis. Am J Obstet Gynecol 1973;116:973.
14. Sanfilippo JS, Wakim NG, Schikler KN, Yussman MA. Endometriosis
in association with uterine anomaly. Am J Obstet Gynecol
1986;154:39.
15. Halban J. Hysteroadenosis metastatica. Wien Klin Wochenschr
1924;37:1205.
16. Gleicher N, el-Roeiy A, Confino E, Friberg J. Is endometriosis
an autoimmune disease ? Obstet Gynecol 1987;70:115.
17. Dmowski W, Braun D, Gebel H. Endometriosis: Genetic and
immunologic aspects. Prog Clin Biol Res 1990;323:99.
18. Nothnick WB. Treating endometriosis as an auto-immune disease.
Fertil Steril 2001;76:223.
19. Laufer MR, Sanfilippo, Rose G. Adolescent endometriosis:
diagnosis and treatment approaches. J Pediatr Adolesc Gynecol
2003;16:S3.
20. Song AH, Advincula AP. Adolescent Chronic Pelvic Pain. J
Pediatr Adolesc Gynecol 2005;18:371.
21. ACOG Committee Opinion: Number 310, April 2005: Endometriosis
in adolescents. J Obstet Gynecol 2005;64:651.
22. Harel Z. Dysmenorrhea in adolescents. Ann NY Acad Sci
2008;1135:185.
23. American Society for Reproductive Medecine: Revised American
Society for Reproductive Medicine classification of endometriosis:
1996. Fertil Steril 1997;67:817.
24. Cook AS, Rock JA. The role of laparoscopy in the treatment of
endometriosis. Fertil Steril 1991;55:663.




