
Par le professeur Lionel Bueno,
Neurogastroenterologie INRA, Toulouse, France
La prévalence du SII dans une même famille a donné lieu à des études rétrospectives visant à identifier des facteurs génétiques de prédisposition et à les comparer aux facteurs environnementaux familiaux ou autre (niveau de vie). Les données physiopathologiques récentes (micro-inflammation colique, augmentation de perméabilité, dysbiose, etc.) dans le SII permettent également de penser que cette pathologie a des points communs avec les pathologies inflammatoires (MICI) et la maladie coeliaque impliquant des facteurs génétiques. De même, des profils génétiques à l’origine d’anomalies de synthèse ou de métabolisme de médiateurs comme la sérotonine, elle-même impliquée dans le contrôle de la motricité et la sensibilité viscérale, ont été recherchés en premier lieu.
Gémellité et SII
Dans un travail publié en 2001, des chercheurs ont analysé la fréquence de SII chez des couples de jumeaux homo- ou hétérozygotes en évaluant à la fois les facteurs génétiques et la composante comportementale d’origine parentale (1). Cette étude à grande échelle qui a porté sur 6 060 paires de jumeaux, a permis de mettre en évidence une concordance de SII plus élevée (13,7 %) chez les jumeaux homozygotes que chez les hétérozygotes (6,7 %), et d’attribuer cette différence à des facteurs génétiques (fig. 1). Toutefois l’incidence de l’environnement familial n’est pas négligeable puisque chez les hétérozygotes, la proportion de jumeaux avec SII dont la mère souffre également de SII est de 15,2 % contre 6,7 % lorsque la mère n’est pas symptomatique. Autrement dit, l’éducation et d’autres facteurs comportementaux de l’environnement familial sont aussi importants que les facteurs génétiques. La possibilité d’interférence d’un contexte de co-morbidité d’origine génétique favorable au développement du SII a été recherchée (2,3)mais aucune de ces études n’a permis d’établir un lien direct même pour les jumeaux homozygotes.
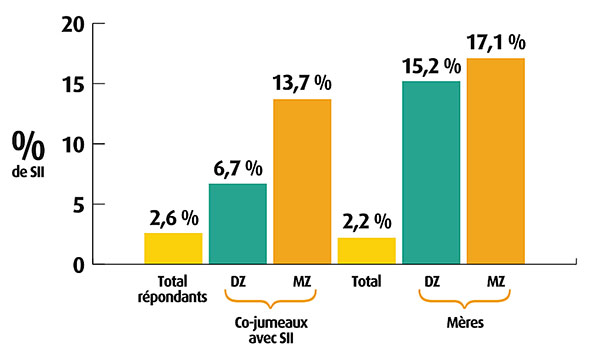 |
|
(D’après Levy et al. Gastroenterology 2001) Evidence comparée de l’influence parentale génétique et comportementale dans l’incidence du SII dans la population (USA). * Cette analyse concerne 12 120 jumeaux ayant répondu à l’enquête dont 291 paires avait un SII (117 monozygotes et 164 hétérozygotes). Moyenne d’age 29-30 ans. Le pourcentage de répondeurs ayant un SII est de 2,6 % comparable à celui des mères de jumeaux (2,2 %). Chez les jumeaux hétérozygotes (DZ) ayant répondu, il est de 6,7 %, 2 fois plus faible que le pourcentage de SII chez les jumeaux homozygotes (MZ) (13,7 %). Dans les 2 cas, cette proportion est plus que doublée lorsque leur mère souffre elle-même d’un SII pour les jumeaux DZ et dans ce cas la différence entre jumeaux DZ et MZ n’est plus significative. |
Influences génétiques et SII
Dans les MICI, l’analyse du génome et les méta- analyses utilisant de nombreuses bases de données portant sur plusieurs centaines de milliers de marqueurs génétiques ont révélé des altérations fréquentes dans l’expression génique de gènes impliqués dans les réponses immunitaires locales (voies de l’IL13 et NOD2) et ceux impliqués dans l’autophagie (ATG16L1 et IRGN). Elles soulignent également les altérations hautement fréquentes dans les gènes impliqués dans le fonctionnement épithélial dans la maladie coeliaque (PARD3 et MAGI2) et la colite ulcéreuse (PARD3 et MAGI2, HNF4A, CDH1 et LAMB1 (4,5). Les études de polyphormismes génétiques simples associées à un seul nucléotide présent ou absent ont confirmé une influence génétique dans le SII. Les polymorphismes associés au SII concernent non seulement les gènes codant pour la synthèse de médiateurs impliqués dans l’immunité de la muqueuse et l’intégrité de la barrière épithéliale mais également la synthèse cytokines telles que IL-10 (6) ou des neuromédiateurs des fonctions digestives.
SII-D et altération de l’expression du transporteur de la recapture de la sérotonine (SERT)
La sérotonine (5-HT) est principalement synthétisée par les cellules entérochromaffines de l’intestin et du colon et est considérée comme le principal neuromédiateur de la motricité et la sensibilité viscérale impliqué dans les troubles associés au SII. Elle active des récepteurs neuronaux et cette activation est sous la dépendance d’un transporteur régulant sa recapture (SERT). Le génotype homozygote court codant pour la synthèse de ce transporteur de la recapture de la sérotonine a été décrit comme associé au phénotype SII avec diarrhées (SII-D) dans 2 cohortes indépendantes de 200 patients par rapport à 440 sujets contrôle (7, 8). Ce génotype court de SERT (SLC6A4) est associé à une diminution de la recapture de la sérotonine et en conséquence à une élévation de son niveau dans la muqueuse colique (9). Cette élévation favoriserait une hypermotricité colique par activation des récepteurs à la sérotonine 5-TH3 et/ou 5-HT4.
Polymorphisme (a) et sous-type de SII
La recherche d’une susceptibilité génétique des patients à développer un SII post-infectieux après une gastroentérite sévère, a révélé l’existence d’anomalies dans les gènes codant pour la synthèse de ”toll-likereceptors” ou TLR (en particulier le TLR-9) intervenant dans l’immunité innée, de cytokines (IL6) et de protéines de jonction (CDH1) (10). En prenant comme critère un phénotype ”transit altéré” chez des patients SII, il a été montré une association avec un polymorphisme d’un gène codant pour un récepteur au Peptide S (NPSR1) exprimé par les cellules entéro-endocrines et qui est impliqué dans les états d’anxiété et la perception douloureuse. Par la suite, compte tenu de l’importance des altérations de la barrière épithéliale et de l’immunité locale dans le SII, des facteurs de susceptibilité génétique communs avec ceux des MICI ont été recherché dans les 30 loci univoques identifiés dans la susceptibilité génétique des MICI. Parmi toutes les séquences évaluées, celles codant pour la synthèse de la protéine TL1A impliquée dans la modulation de la réponse inflammatoire sont associées à une augmentation du risque de SII (11, 12).
Multiplication des polymorphismes associés aux TFI
Dans la seule période 2011-2012, on compte pas moins de 9 publications sur les associations entre polymorphismes génétiques et SII ou dyspepsie fonctionnelle. Elles concernent des protéines impliquées dans la signalisation intracellulaire pouvant jouer un rôle dans la régulation de la motricité et/ou la sensibilité viscérale ou encore des récepteurs impliqués dans la transmission de signaux nociceptifs (13, 14).
Conclusion
Il existe des altérations d’expression ou de configuration (polymorphisme) de gènes, associées au SII mais ces altérations portent sur l’expression de protéines dont l’implication dans la pathogénèse du SII reste à démontrer. Par ailleurs à l’heure actuelle aucune étude de cohortes n’a été réalisée pour démontrer la sélectivité ou la spécificité de ces altérations par analyse statistique ROC. Les facteurs environnementaux, ou alimentaires au même titre que les altérations de la barrière épithéliale et la dysbiose (déséquilibre du microbiote intestinal) associée restent les avancées les plus significatives dans la connaissance de cette pathologie.
(a) Le polymorphisme génétique est la coexistence de plusieurs allèles pour un gène ou locus donné, dans une population. Il correspond aux variations de la séquence nucléotidique de l'ADN d'un gène. Un gène est considéré comme polymorphe s'il existe au moins deux allèles à une fréquence égale ou supérieure à 1 %.
1. Levy RLet al. Irritable bowel syndrome in twins: heredity
and social learning both contribute to etiology. Gastroenterology.
2001; 121:799-804.
2. Mohammed I et al.Genetic influences in irritable bowel syndrome:
a twin study. Am J Gastroenterol. 2005; 100:1340-4.
3. Wojczynski MK et al.Irritable bowel syndrome: a co-twin control
analysis. Am J Gastroenterol. 2007; 102:2220-9.
4. Wapenaar MC et al. Associationswith tight junction genes PARD3
and MAGI2 in Dutch patients point to a commonbarrierdefect for
coeliacdisease and ulcerativecolitis. Gut. 2008;57: 463-7.
5. Barrett JC et al. Genome-wide association study of
ulcerativecolitis identifies three new susceptibilityloci,
including the HNF4A region. Nat Genet. 2009; 41:1330-4.
6. Gonsalkorale MW et al. Interleukin 10 genotypes in irritable
bowel syndrome: evidence for an inflammatory component? Gut. 2003;
52: 91-93.
7. Yeo A et al. Association between a functional polymorphism in
the serotonin transporter gene and diarrhoea predominant irritable
bowel syndrome in women. Gut. 2004; 53:1452-8.
8. Park JM et al. Serotonin transporter gene polymorphism and
irritable bowel syndrome. NeurogastroenterolMotil. 2006; 18(11):
995-1000.
9. Kumar S et al. Serotonin transporter gene (SLC6A4) polymorphism
in patients with irritable bowel syndrome and healthy controls. J
Gastrointestin Liver Dis. 2012; 21: 31-8.
10. Villani AC et al. Genetic risk factors for post-infectious
irritable bowel syndrome following a waterborne outbreak of
gastroenteritis. Gastroenterology. 2010; 138:1502-13.
11. Zucchelli M et al. Association of TNFSF15 polymorphism with
irritable bowel syndrome. Gut. 2011; 60: 1671-7.
12. Heyes MP et al. Quinolinic acid and kynurenine pathway
metabolism in inflammatory and non-inflammatory neurological
disease. Brain. 1992; 115: 1249-73. 13. Kim HG et al. G-Protein
Beta3 Subunit C825T polymorphism in patients with overlap syndrome
of functional dyspepsia and irritable bowel syndrome. J
NeurogastroenterolMotil. 2012; 18: 205-10.
14. Song YA, et al. Association between single nucleotide
polymorphisms of the transient receptor potential vanilloid 1
(TRPV-1) gene and patients with irritable bowel syndrome in Korean
populations. Acta GastroenterolBelg. 2012; 75: 222-7.




