Wim Ceelen1, Karen Geboes2, Stéphanie Laurent2, Yves Van Nieuwenhove1, Piet Pattyn1
1. Chirurgie gastro-intestinale, UZ Gent 2. Oncologie digestive,
UZ Gent
Ces dernières années, le traitement du carcinome colorectal (CCR) métastatique a énormément progressé, sauf pour les patients présentant une carcinose péritonéale (CP) d’origine colorectale. Dans ce cas de figure, la réponse au traitement et le pronostic semblent en effet nettement moins favorables qu’en cas de métastases aux organes. En outre, les connaissances relatives à la pathogenèse moléculaire de la formation de métastases péritonéales sont très limitées. Récemment, la chirurgie de réduction tumorale suivie d’une chimiothérapie par perfusion intrapéritonéale a été ajoutée à l’arsenal thérapeutique disponible pour les patients présentant des métastases péritonéales. Aussi, ce traitement est de plus en plus appliqué partout dans le monde. Ci-après, nous donnons un aperçu de l’épidémiologie, de la pathogenèse et des possibilités de traitement de la carcinose péritonéale secondaire au carcinome colorectal.
Épidémiologie et facteurs de risque
Au moment du diagnostic, des métastases péritonéales synchrones
sont décelées chez environ 4 à 7% des patients atteints d’un CCR;
dans près de la moitié des cas, il s’agit de la seule localisation
métastatique (1). Par ailleurs, dans 4 à 20% des cas, une CP
métachrone est découverte lors du suivi consécutif au traitement de
première intention. Une étude de cohorte a révélé que les éléments
indépendants suivants constituent des facteurs prédictifs de la
survenue d’une CP: stade T avancé, stade N avancé, tumeur primitive
dans le côlon (versus rectum), cancer du côlon droit, jeune âge,
tumeurs mucineuses et résection en urgence ou oncologiquement
incomplète (2). Le risque est également élevé en cas de tumeurs
perforées et après résection de métastases ovariennes (tumeurs de
Krukenberg).
Environ 5 à 20% des patients atteints d’un carcinome colorectal
(CCR) développent des métastases péritonéales synchrones ou
métachrones. La pathogenèse de la carcinose péritonéale (CP) peut
se définir comme un phénomène progressif caractérisé successivement
par la libération de cellules tumorales isolées, leur transport à
travers la cavité abdominale, leur adhérence au mésothélium et,
pour finir, l’envahissement des tissus sous-mésothéliaux. La
TEP-TDM au FDG et l’IRM de diffusion peuvent être utilisées pour la
stadification de la CP, mais sous-estiment souvent l’étendue de la
maladie. Le traitement systémique par chimiothérapie et médicaments
biologiques est actif en cas de carcinose colorectale, mais semble
moins efficace qu’en cas de métastases aux organes. Un petit groupe
de patients sont potentiellement candidats pour une chirurgie de
réduction tumorale (CRT) combinée à une chimiothérapie
intrapéritonéale administrée en peropératoire, généralement sous la
forme d’une chimiothérapie hyperthermique intrapéritonéale (CHIP).
Si l’intervention est pratiquée par un médecin expérimenté, la
toxicité et les complications post-opératoires consécutives à une
CRT + CHIP sont limitées. Néanmoins, il convient de tenir compte
d’un risque accru de lâchage de suture. Les agents
chimiothérapeutiques les plus utilisés pour la CHIP dans le cadre
d’un CCR sont l’oxaliplatine (dose de 200-460mg/m2) et
la mitomycine C (35mg/m2). Les critères de sélection en
défaveur d’un traitement chirurgical reposent sur la présence
éventuelle d’ascite, d’une atteinte de l’intestin grêle et d’une
maladie extra-abdominale. Une étude randomisée et quelques séries
monocentriques et multicentriques montrent qu’en cas de résection
macroscopiquement complète, il est possible d’atteindre une survie
médiane de 40 mois ou plus. Le rôle de la chimiothérapie
néoadjuvante et du traitement post-opératoire n’est pas encore bien
déterminé.
Chez les patients opérés pour un CCR présentant un risque élevé de récidive péritonéale, la planification d’une intervention de contrôle avec administration préventive d’une CHIP peut se révéler utile. Enfin, nous avons besoin de nouveaux médicaments, notamment des nanotransporteurs, spécifiquement conçus pour l’administration intrapéritonéale. Les caractéristiques moléculaires qui augmentent le risque de CP sont peu connues, mais récemment, des travaux de recherche ont suggéré que les personnes porteuses d’une mutation du gène BRAF présentaient un risque significativement supérieur de développer une CP (3).
Pathogenèse
La pathogenèse de la carcinose péritonéale peut se définir comme une succession d’étapes temporelles, qui se chevauchent néanmoins.
Libération de cellules tumorales dans le péritoine
Des cellules tumorales isolées peuvent se détacher (shedding) de la surface des tumeurs colorectales en contact avec la cavité abdominale. Cette libération de cellules tumorales est facilitée par la pression tissulaire interstitielle élevée due, d’une part, à la prolifération cellulaire et, d’autre part, à l’absence ou au dysfonctionnement du système lymphatique (4). La perforation de la tumeur dans la cavité abdominale libre constitue en outre un facteur de risque connu de la survenue d’une carcinose péritonéale et d’une diminution des chances de guérison (5). Il peut également être question d’une dissémination iatrogène causée par la manipulation, la stimulation ou l’excision de tissu tumoral. Ce phénomène est notamment illustré par les résultats de l’étude sur la résection totale du mésorectum (TME) dans le cadre du traitement du cancer du rectum, laquelle est associée à une nette diminution du taux de récidive locale du fait de l’absence de dissection dans les foyers tumoraux mésorectaux (6). Un autre exemple est l’apparition d’implants métastatiques dans la plaie chirurgicale après une chirurgie tumorale par voie ouverte ou laparoscopique (7). La réalisation d’une dissection de ganglions lymphatiques peut provoquer la dissémination de cellules tumorales. Enfin, il a été démontré que la dissection tant des vaisseaux sanguins que des voies biliaires peut causer la libération de cellules tumorales (8, 9).
Dissémination des cellules tumorales dans la cavité abdominale
La dissémination des cellules tumorales dans la cavité abdominale est facilitée, d’une part, par la motilité intrinsèque des cellules malignes et, d’autre part, par la circulation lymphatique physiologique dans l’abdomen. Du fait de la pression négative dans l’épigastre pendant l’inspiration, cette circulation lymphatique physiologique s’effectue de bas en haut, ce qui explique pourquoi la carcinose péritonéale touche le plus souvent les surfaces péritonéales diaphragmatiques (10). D’autres localisations fréquentes des implants péritonéaux sont l’omentum et le petit bassin. L’atteinte fréquente du grand omentum est quelque peu paradoxale, étant donné la présence de nombreuses cellules immunocompétentes dans les «taches laiteuses» (11). Une explication possible réside dans la mobilité relativement faible et la structure irrégulière de l’omentum, qui pourraient faciliter l’adhérence des cellules tumorales. Par ailleurs, il a été démontré in vitro que les adipocytes omentaux stimulent l’invasion des cellules tumorales et qu’ils les approvisionnent en énergie sous la forme d’acides gras (12).
Adhérence des cellules tumorales aux surfaces péritonéales
La première étape dans la formation d’une métastase péritonéale
est l’adhérence de la cellule tumorale à la cellule mésothéliale.
Cette dernière exprime une série de molécules d’adhérence (ICAM,
VCAM, sélectines, intégrines et CD44), dont il a été prouvé
qu’elles jouent un rôle tant dans la réponse inflammatoire du
mésothélium que dans l’adhérence des cellules tu- morales (13).
Selon le type de tumeur, l’adhérence de la cellule maligne aux
surfaces mésothéliales est suivie d’une prolifération superficielle
ou de l’envahissement de la membrane basale sous-mésothéliale et de
la matrice sous-jacente. Des études in vitro récentes
suggèrent que l’envahissement est favorisé par l’apoptose des
cellules mésothéliales induite par un mécanisme dépendant de la
voie Fas/FasL (14). Une dissémination systémique de cellules
tumorales métastatiques péritonéales peut avoir lieu au niveau du
diaphragme, là où la cavité péritonéale communique avec un réseau
lymphatique via des lacunes et des fenestrations.
Diagnostic et stadification
En raison de leurs petites dimensions, les implants péritonéaux sont difficiles à déceler via l’imagerie. Une étude récente a révélé un coefficient de corrélation entre l’imagerie et les constatations chirurgicales de seulement 0,12 pour la TEP-TDM au 18-FDG et de 0,53 pour la TDM (15). L’IRM de diffusion accroît sensiblement la précision de l’imagerie, mais la détection des anomalies sub-centimétriques reste problématique (16).
Pour la stadification chirurgicale de la CP, on utilise souvent des systèmes de scores adaptés tels que le PCI (Peritoneal Cancer Index) de Sugarbaker, le score de Gilly, le PCI simplifié et plusieurs autres systèmes qui prennent en considération la localisation anatomique ainsi que la taille des métastases péritonéales. Ces systèmes de scores jouent incontestablement un rôle majeur dans la description de populations de patients dans le cadre de la recherche clinique. En revanche, pour la définition de la stratégie individuelle, ils sont moins importants, dans la mesure où ce n’est pas tant le nombre de métastases péritonéales (MP) ni leur localisation qui sont déterminants, mais plutôt le caractère invasif des implants péritonéaux et l’atteinte de structures vitales telles que l’intestin grêle ou le hile du foie. La présence d’ascites cliniquement observables est généralement le signe d’une carcinose très étendue et n’entrant pas en ligne de compte pour un traitement chirurgical.
La place de la laparoscopie dans le diagnostic et la stadification de la CP colorectale est relativement limitée. Souvent, les patients concernés ont déjà subi des interventions chirurgicales majeures, ce qui complique sérieusement la réalisation d’une évaluation laparoscopique approfondie. Il faut en outre tenir compte du risque réel de formation d’implants métastatiques se développant rapidement au niveau des incisions pratiquées pour réaliser la laparoscopie.
Traitement de la carcinose péritonéale d’origine colorectale
Traitement systémique
Aucune étude clinique prospective n’a jusqu’à présent évalué l’efficacité du traitement systémique chez des patients atteints d’un CCR métastatique limité aux surfaces péritonéales. Néanmoins, les données recueillies dans le cadre d’études rétrospectives et de registres de populations permettent de faire un certain nombre de constatations. Tout d’abord, il est avéré que la chimiothérapie palliative prolonge aussi la survie des patients présentant une CP. Dans une cohorte de 256 patients présentant une CP, Pelz et ses collaborateurs ont constaté que l’administration d’un traitement systémique moderne était associé à une hausse de la survie médiane de 7 à 18 mois (p = 0,054), en comparaison avec l’utilisation de 5-FU seul ou l’absence de chimiothérapie (17). Par ailleurs, il a été démontré dans plusieurs études que la présence d’une CP constitue un marqueur prédictif et pronostique défavorable chez les patients atteints d’un CCRm qui sont traités par chimiothérapie palliative avec ou sans médicaments biologiques. Il convient également de signaler que la progression des métastases péritonéales cause beaucoup plus rapidement des symptômes majeurs que les métastases pulmonaires ou hépatiques. Une analyse de sous-groupes de deux essais randomisés portant sur le CCRm (N979741: FOLFOX versus FOLFIRI versus IROX, et N9841: irinotécan versus FOLFOX) a suggéré que tant la survie globale que la survie sans progression étaient significativement inférieures chez les patients qui présentaient une CP (hazard ratio de respectivement 1,2-1,5; p < 0,001 et 1,1-1,3; p = 0,001) (18).
Chimiothérapie intrapéritonéale
Le fondement de la chimiothérapie intrapéritonéale (IP) repose, d’une part, sur l’existence de la barrière péritonéoplasmatique, qui permet de limiter au maximum les effets secondaires systémiques, et, d’autre part, sur la possibilité d’obtenir, en cas de contact direct, une action antitumorale plus efficace via la diffusion et la convection dans de petits nodules tumoraux mal vascularisés. Dans des modèles animaux, la chimiothérapie IP permet de prévenir le développement d’une CP après injection de cellules tumorales dans la cavité abdominale. Plusieurs auteurs ont examiné si la chimiothérapie IP adjuvante à base de 5-FU permettait de prévenir une récidive péritonéale après une chirurgie à vocation curative pour un CCR. Les résultats divergent: dans deux études randomisées, les chercheurs ont constaté un risque de récidive péritonéale significativement inférieur dans le groupe de patients qui avaient reçu une chimiothérapie IP à base de 5-FU, tandis qu’une troisième étude comparative n’a pas révélé le moindre effet sur le risque de récidive péritonéale (19, 20). L’utilisation peropératoire de la chimiothérapie par perfusion hyperthermique de la cavité abdominale a été décrite pour la première fois dans un modèle animal par Euler en 1974 (21). La première application clinique a été décrite en 1980 par Spratt, qui avait pratiqué une CRT (chirurgie de réduction tumorale) et une CHIP à base de thiotépa sur un patient présentant un pseudomyxome péritonéal (22). Depuis lors, la combinaison CRT + CHIP est appliquée partout dans le monde. Ces 5 dernières années en particulier, tant le nombre de centres qui appliquent cette technique que les données scientifiques relatives à la chimiothérapie IP ont connu une forte augmentation. L’avantage de l’administration peropératoire de la chimiothérapie par perfusion (immédiatement après la CRT) réside dans le fait que l’effet de la chimiothérapie n’est pas entravé par des adhérences post-opératoires, contrairement à ce qui se passe en cas d’administration post-opératoire par le biais d’un cathéter. La combinaison chimiothérapie par perfusion + hyperthermie repose sur plusieurs constatations précliniques. Tout d’abord, l’hyperthermie (T > 40° C) est sélectivement toxique pour les cellules malignes (23). Ensuite, elle stimule l’activité cytotoxique d’un certain nombre d’agents chimiothérapeutiques (notamment les dérivés du platine et les agents alkylants) (24). Enfin, dans des modèles animaux, on a constaté que l’hyperthermie contribuait à accroître la profondeur de pénétration du cisplatine dans les nodules tumoraux (25).
Jusqu’à présent, aucune étude comparant la chimiothérapie par perfusion hyperthermique et normothermique n’a été effectuée chez l’être humain.
Sélection des patients candidats à une chirurgie de réduction tumorale + CHIP
Contrairement aux tumeurs mucineuses appendiculaires de bas grade et au pseudomyxome, la CP secondaire à un carcinome colorectal est une manifestation d’une maladie à haut risque, pour laquelle une guérison définitive n’est généralement pas une option réaliste. Les avantages et les inconvénients de la CRT + CHIP doivent être soigneusement pesés par une équipe multidisciplinaire. Les critères de sélection généraux sont les suivants: absence de maladie extra-abdominale; absence d’ascites et/ou de sous-occlusion de l’intestin grêle cliniquement observables; la charge tumorale peut être éliminée (presque) complètement par voie chirurgicale, avec des conséquences acceptables sur la qualité de vie; absence de progression sous chimiothérapie préalable. La présence de métastases hépatiques limitées et résécables ne constitue pas en soi une contre-indication pour la CRT + CHIP.
Aspects techniques de la CRT + CHIP
Le premier objectif est de parvenir à une réduction tumorale macroscopiquement complète par le biais d’une combinaison de résection d’organe et de péritonectomies. Les petits implants miliaires sont généralement traités par coagulation ou fulguration à l’argon. Un circuit de perfusion composé d’une pompe péristaltique, d’un ou de plusieurs cathéters d’entrée et de sortie et de capteurs de température est ensuite immédiatement installé. La chimiothérapie par perfusion peut être réalisée avec l’abdomen temporairement fermé ou avec l’abdomen ouvert (technique du colisée: la paroi abdominale est attachée à un cadre de fixation). La technique ouverte permet de distribuer manuellement la chimiothérapie pendant la perfusion, tandis que la technique fermée permet, en théorie, d’appliquer une pression intra-abdominale plus élevée, ce qui peut favoriser la convection des médicaments macromoléculaires dans le tissu tumoral. Jusqu’à présent, aucune étude n’a comparé ces deux techniques. Dès que le perfusat a atteint la température souhaitée (généralement 40 à 42° C), la chimiothérapie est introduite dans le circuit et la perfusion est poursuivie pendant 30 à 90 minutes. Les agents chimiothérapeutiques les plus utilisés pour la CHIP dans le cadre d’un CCR sont l’oxaliplatine (dose de 200-460mg/m2) et la mitomycine C (35mg/m2).
Résultats cliniques de la CRT + CHIP dans le cadre du cancer du côlon
Le tableau dresse un aperçu des résultats d’études cliniques qui ont été menées auprès de patients souffrant d’une CP secondaire à un CCR qui ont été traités par CRT + CHIP. La seule étude prospective randomisée a été réalisée en 2003 par Verwaal et al. (26). Dans celle-ci, des patients atteints d’une CP (n = 105) ont été traités par chimiothérapie palliative seule (à l’époque, le 5-FU et la leucovorine étaient encore utilisés) ou par CRT/CHIP suivie d’une chimiothérapie palliative. La survie spécifique médiane s’est élevée à 12,6 mois dans le bras de contrôle, contre 22,2 mois dans le bras CRT/CHIP (p = 0,028); la survie était nettement supérieure si moins de 5 des 7 régions abdominales étaient atteintes et lorsqu’une réduction tumorale pratiquement complète était possible. Les résultats des études monocentriques et multicentriques non randomisées sont similaires: la survie globale médiane est d’environ deux ans, mais chez les patients qui peuvent subir une résection macroscopiquement complète (CC-0) et être traités par chimiothérapie peropératoire, la survie médiane peut atteindre plus de quatre ans.
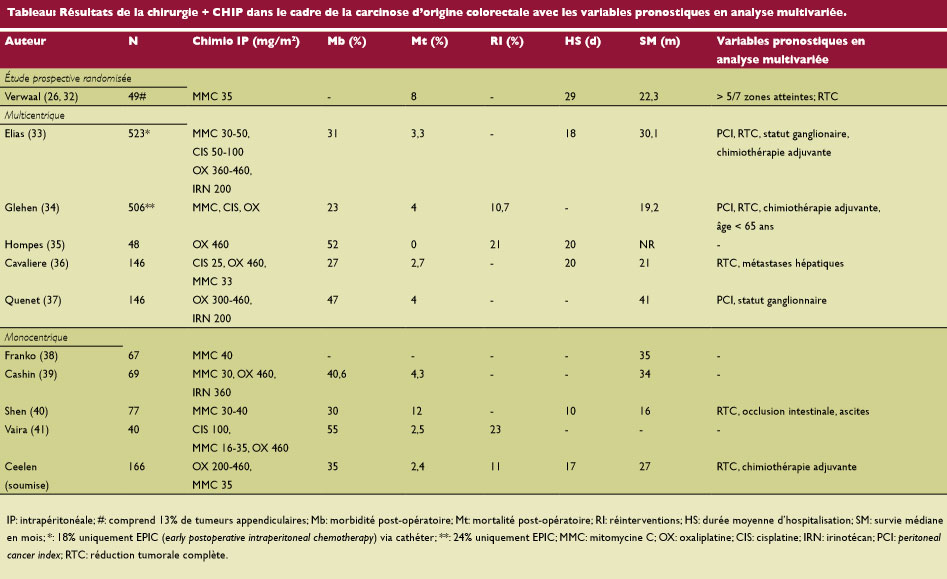
Toxicité et complications de la chirurgie de réduction tumorale + CHIP pour le CCR
L’adjonction de la CHIP augmente sensiblement le risque opératoire. En effet, cette intervention est associée à un risque accru de lâchage de suture, un phénomène observé tant dans les modèles animaux que dans la pratique clinique (27). La toxicité systémique de la chimiothérapie IP est minime, dans la mesure où les concentrations plasmatiques restent très faibles. À de très hautes températures, l’hyperthermie peut causer un œdème des tissus de l’intestin grêle et un iléus post-opératoire très long. L’intensité des adhérences post-opératoires après une CHIP n’est pas particulièrement plus élevée qu’en cas d’autre intervention chirurgicale majeure, et la procédure peut au besoin être répétée plusieurs fois en cas de récidives.
Application préventive de la CHIP en cas de carcinome colorectal
Étant donné que les facteurs de risque cliniques et pathologiques du développement d’une CP sont bien documentés, on pourrait envisager de réaliser une chimiothérapie par perfusion «préventive» lorsqu’il existe des facteurs de risque de CP métachrone (après résection complète de métastases péritonéales synchrones très limitées, en cas de tumeurs perforées ou après résection de métastases ovariennes). Elias et al. ont décrit une approche d’intervention de contrôle systématique dans ce groupe de patients (28). Dans 56% des cas, une récidive péritonéale asymptomatique et non visible à l’imagerie a été décelée. Une CHIP a été administrée à tous les patients (et donc à titre «préventif» chez une partie d’entre eux) et seuls 2 sujets sur 41 ont développé une récidive péritonéale. Sammartino et ses collaborateurs ont rapporté des résultats comparables: chez des patients présentant des tumeurs mucineuses du côlon cT3/T4, l’approche omentectomie + annexectomie + CHIP «préventives» était associée à un risque de développement d’une CP significativement inférieur à celui observé en cas d’intervention standard (4 contre 22%, p < 0,05) (29).
Sur la base de ces résultats, une étude prospective randomisée multicentrique (ProphyloChip, NCT 01226394) a été lancée en France afin de comparer le suivi standard avec une approche associant chirurgie de contrôle planifiée et CHIP chez des patients présentant un risque élevé de CP métachrone.
Chimiothérapie néoadjuvante et adjuvante
Comme dans le cas de métastases hépatiques potentiellement
résécables, l’indication de la chimiothérapie néoadjuvante avant la
CRT + CHIP est incertaine. Jusqu’à présent, aucune étude clinique
ne s’est penchée sur cette question. L’un des arguments en faveur
du traitement néoadjuvant est qu’il permet d’intercaler une fenêtre
d’observation biologique et de voir ainsi si le patient développe
une maladie systémique ou une
progression locale. Par ailleurs, en cas de bonne réponse,
l’étendue de l’intervention chirurgicale peut être réduite. D’après
notre expérience, nous constatons que les patients répondent
souvent très bien à un traitement combiné avec le bévacizumab, ce
qui est probablement lié au rôle du VEGF dans la pathogenèse des
ascites malignes et la propagation de la carcinose péritonéale
(30).
La chimiothérapie adjuvante après une CRT + CHIP pour une carcinose colorectale est également indiquée. En effet, chez ces patients à haut risque, il convient d’envisager un risque élevé de maladie résiduelle microscopique, systémique ou non, même en cas de résection macroscopiquement complète. En outre, on sait qu’une intervention chirurgicale étendue et les processus de cicatrisation des plaies qui l’accompagnent peuvent stimuler la croissance d’une maladie résiduelle minimale (31). Enfin, plusieurs études prospectives (Tableau) montrent que la chimiothérapie adjuvante constitue un paramètre pronostique favorable indépendant après une CRT + CHIP.
Perspectives d’avenir
Même si l’utilisation de la technique CRT + CHIP connaît une forte augmentation ces dernières années, plusieurs questions majeures restent sans réponse. Tout d’abord, il n’est toujours pas prouvé avec certitude que l’approche CRT + CHIP est supérieure à la chimiothérapie palliative moderne avec ou sans médicaments biologiques. L’étude randomisée de Verwaal et al. date de la période où le 5-fluorouracil était le traitement standard pour le carcinome colorectal métastatique. Aux États-Unis, le National Cancer Institute a lancé une étude prospective randomisée dans le but de comparer la chimiothérapie «moderne» seule avec l’association CRT + CHIP + chimiothérapie moderne dans le cadre du traitement de la CP d’origine colorectale (NCT 01167725). La phase d’inclusion semble cependant très lente. Une étude similaire de phase III a été initiée à Uppsala (NCT 01524094), mais son statut est incertain. De manière générale, il est difficile de comparer la CRT + CHIP à une approche non chirurgicale dans le cadre d’une étude randomisée. Tout d’abord, il existe une grande hétérogénéité en termes de lésions, de caractéristiques histologiques, d’expertise chirurgicale, etc. En outre, pour le patient, il y a généralement une différence fondamentale entre une approche chirurgicale et une prise en charge purement médicamenteuse de la CP, ce qui rend problématique la décision de participer à ce genre d’étude. Il faut également signaler que la résection hépatique pour des métastases colorectales n’a jamais été comparée à la chimiothérapie seule dans le cadre d’une étude randomisée. r ailleurs, l’élément qui prévaut pour l’efficacité du traitement combiné n’est pas déterminé avec précision: est-ce la chirurgie de réduction tumorale proprement dite ou l’ajout de la CHIP ? Étant donné que différents auteurs ont retenu la réduction tumorale complète comme facteur pronostique indépendant et qu’aucune différence significative en termes de survie n’a été décrite sous l’effet de divers régimes de chimiothérapie IP (mitomycine, oxaliplatine seul, oxaliplatine avec irinotécan, etc.), la résection complète des lésions péritonéales semble de loin être l’élément le plus important du traitement. Cette question est actuellement examinée dans une étude multicentrique française (Prodige 7/ACCORD 15, NCT 00769405), qui compare la CRT seule avec la CRT + CHIP pour la carcinose d’origine colorectale.
Aucun des agents chimiothérapeutiques actuellement utilisés dans le cadre de la CHIP n’a été spécifiquement développé pour une application IP. Des médicaments nanomoléculaires et des gels thermosensibles à élution médicamenteuse ont notamment montré des résultats très prometteurs dans des travaux de recherche expérimentale sur des animaux. La transposition de ces derniers dans la pratique clinique constitue dès lors une priorité.
Références
1. Koppe MJ, Boerman OC, Oyen WJG, Bleichrodt RP. Peritoneal
carcinomatosis of colorectal origin Incidence and current treatment
strategies. Ann Surg 2006;243(2):212-22.
2. Segelman J, Granath F, Holm T, Machado M, Mahteme H, Martling A.
Incidence, prevalence and risk factors for peritoneal
carcinomatosis from colorectal cancer. Br J Surg
2012;99(5):699-705.
3. Tran B, Kopetz S, Tie J, et al. Impact of BRAF Mutation and
Microsatellite Instability on the Pattern of Metastatic Spread and
Prognosis in Metastatic Colorectal Cancer. Cancer
2011;117(20):4623-32.
4. Tredan O, Galmarini CM, Patel K, Tannock IF. Drug resistance and
the solid tumor microenvironment. J Natl Cancer Inst
2007;99(19):1441-54.
5. McArdle CS, McMillan DC, Hole DJ. The impact of blood loss,
obstruction and perforation on survival in patients undergoing
curative resection for colon cancer. Br J Surg
2006;93(4):483-8.
6. Ceelen W, Pattyn P. Total mesorectal excision in the treatment
of rectal cancer: a review. Acta Chir Belg 2000;100(3):94-9.
7. Savalgi RS. Port-site metastasis in the abdominal wall: Fact or
fiction? Semin Surg Oncol 1998;15(3):189-93.
8. Hansen E, Wolff N, Knuechel R, Ruschoff J, Hofstaedter F, Taeger
K. Tumor-Cells in Blood Shed from the Surgical Field. Arch Surg
1995;130(4):387-93.
9. Verbeek PCM, Vanderheyde MN, Ramsoekh T, Bosma A.
Clinical-significance of implantation metastases after
surgical-treatment of cholangiocarcinoma. Semin Liver Dis
1990;10(2):142-4.
10. Meyers MA. Distribution of Intra-abdominal Malignant Seeding
Dependency on Dynamics of Flow of Ascitic Fluid. Am J Roentgenology
1973;119(1):198-206.
11. Oosterling SJ, van der Bij GJ, Bogels M, et al. Insufficient
ability of omental milky spots to prevent peritoneal tumor
outgrowth supports omentectomy in minimal residual disease. Cancer
Immunol Immunother 2006;55(9):1043-51.
12. Nieman KM, Kenny HA, Penicka CV, et al. Adipocytes promote
ovarian cancer metastasis and provide energy for rapid tumor
growth. Nat Med 2011;17(11):1498-U207.
13. Jayne DG. The molecular biology of peritoneal carcinomatosis
from gastrointestinal cancer. Ann Acad Med Singapore
2003;32(2):219-25.
14. Heath RM, Jayne DG, O’Leary R, Morrison EE, Guillou PJ.
Tumour-induced apoptosis in human mesothelial cells: a mechanism of
peritoneal invasion by Fas Ligand/Fas interaction. Br J Cancer
2004;90(7):1437-42.
15. Dromain C, Leboulleux S, Auperin A, et al. Staging of
peritoneal carcinomatosis: enhanced CT vs. PET/CT. Abdom Imaging
2008;33(1):87-93.
16. Low RN, Barone RM. Combined diffusion-weighted and
gadolinium-enhanced MRI can accurately predict the peritoneal
cancer index preoperatively in patients being considered for
cytoreductive surgical procedures. Ann Surg Oncol
2012;19(5):1394-401.
17. Kerscher AG, Chua TC, Gasser M, et al. Impact of peritoneal
carcinomatosis in the disease history of colorectal cancer
management: a longitudinal experience of 2406 patients over two
decades. Br J Cancer 2013;108(7):1432-9.
18. Franko J, Shi Q, Goldman CD, et al. Treatment of Colorectal
Peritoneal Carcinomatosis With Systemic Chemotherapy: A Pooled
Analysis of North Central Cancer Treatment Group Phase III Trials
N9741 and N9841. J Clin Oncol 2012;30(3):263-7.
19. Scheithauer W, Kornek GV, Marczell A, et al. Combined
intravenous and intraperitoneal chemotherapy with fluorouracil plus
leucovorin vs fluorouracil plus levamisole for adjuvant therapy of
resected colon carcinoma. Br J Cancer 1998;77(8):1349-54.
20. Vaillant JC, Nordlinger B, Deuffic S, et al. Adjuvant
intraperitoneal 5-fluorouracil in high-risk colon cancer A
multicenter phase III trial. Ann Surg 2000;231(4):449-56.
21. Euler J, Prieschi.A, Wenzl J, Sauerman.G, Klockler K,
Kretschm.G. Hyperthermic peritoneal perfusion in ascites tumors in
rats. Wien Klin Wochenschr 1974;86(8):220-5.
22. Spratt JS, Adcock RA, Muskovin M, Sherrill W, Mckeown J.
Clinical Delivery System for Intra-Peritoneal Hyperthermic
Chemotherapy. Cancer Res 1980;40(2):256-60.
23. Hildebrandt B, Wust P, Ahlers O, et al. The cellular and
molecular basis of hyperthermia. Crit Rev Oncol Hematol
2002;43(1):33-56.
24. Raaphorst GP, Yang DP. The evaluation of thermal cisplatin
sensitization in normal and XP human cells using mild hyperthermia
at 40 and 41 degrees C. Anticancer Res 2005;25(4):2649-53.
25. Los G, Sminia P, Wondergem J, et al. Optimization of
Intraperitoneal Cisplatin Therapy with Regional Hyperthermia in
Rats. Eur J Cancer 1991;27(4):472-7.
26. Verwaal VJ, van Ruth S, de Bree E, et al. Randomized trial of
cytoreduction and hyperthermic intraperitoneal chemotherapy versus
systemic chemotherapy and palliative surgery in patients with
peritoneal carcinomatosis of colorectal cancer. J Clin Oncol
2003;21(20):373743.
27. Blouhos K, Pramateftakis MG, Tsachalis T, et al. The integrity
of colonic anastomoses following the intraperitoneal administration
of oxaliplatin. Int J Colorectal Dis 2010;25(7):835-41.
28. Elias D, Honore C, Dumont F, et al. Results of Systematic
Second-look Surgery Plus HIPEC in Asymptomatic Patients Presenting
a High Risk of Developing Colorectal Peritoneal Carcinomatosis. Ann
Surg 2011;254(2):289-93.
29. Sammartino P, Sibio S, Biacchi D, et al. Prevention of
Peritoneal Metastases from Colon Cancer in High-Risk Patients:
Preliminary Results of Surgery plus Prophylactic HIPEC.
Gastroenterol Res Pract 2012.
30. Moghaddam SM, Amini A, Morris DL, Pourgholami MH. Significance
of vascular endothelial growth factor in growth and peritoneal
dissemination of ovarian cancer. Cancer Metastasis Rev
2012;31(1-2):143-62.
31. Hedley BD, Chambers AF. Tumor Dormancy and Metastasis. In:
Woude GFV, Klein G, eds. Advances in Cancer Research, Vol 102. San
Diego: Elsevier Academic Press Inc; 2009: 67-101.
32. Verwaal VJ, Bruin S, Boot H, van Slooten G, van Tinteren H.
8-year follow-up of randomized trial: Cytoreduction and
hyperthermic intraperitoneal chemotherapy versus systemic
chemotherapy in patients with peritoneal carcinomatosis of
colorectal cancer. Ann Surg Oncol 2008;15(9):2426-32.
33. Elias D, Lefevre JH, Chevalier J, et al. Complete Cytoreductive
Surgery Plus Intraperitoneal Chemohyperthermia With Oxaliplatin for
Peritoneal Carcinomatosis of Colorectal Origin. J Clin Oncol
2009;27(5):681-5.
34. Glehen O, Kwiatkowski F, Sugarbaker PH, et al. Cytoreductive
surgery combined with perioperative intraperitoneal chemotherapy
for the management of peritoneal carcinomatosis from colorectal
cancer: A multi-institutional study. J Clin Oncol
2004;22(16):3284-92.
35. Hompes D, D’Hoore A, Van Cutsem E, et al. The treatment of
peritoneal carcinomatosis of colorectal cancer with complete
cytoreductive surgery and hyperthermic intraperitoneal peroperative
chemotherapy (HIPEC) with oxaliplatin: a belgian multicentre
prospective phase II clinical study. Ann Surg Oncol
2012;19(7):2186-94.
36. Cavaliere F, De Simone M, Virzi S, et al. Prognostic factors
and oncologic outcome in 146 patients with colorectal peritoneal
carcinomatosis treated with cytoreductive surgery combined with
hyperthermic intraperitoneal chemotherapy: Italian multicenter
study S.I.T.I.L.O. Ejso 2011;37(2):148-54.
37. Quenet F, Goere D, Mehta SS, et al. Results of two
bi-institutional prospective studies using intraperitoneal
oxaliplatin with or without irinotecan during HIPEC after
cytoreductive surgery for colorectal carcinomatosis. Ann Surg
2011;254(2):294-301.
38. Franko J, Ibrahim Z, Gusani NJ, Holtzman MP, Bartlett DL, Zeh
HJ. Cytoreductive Surgery and Hyperthermic Intraperitoneal
Chemoperfusion Versus Systemic Chemotherapy Alone for Colorectal
Peritoneal Carcinomatosis. Cancer 2010;116(16):3756-62.
39. Cashin PH, Graf W, Nygren P, Mahteme H. Cytoreductive surgery
and intraperitoneal chemotherapy for colorectal peritoneal
carcinomatosis: prognosis and treatment of recurrences in a cohort
study. Ejso 2012;38(6):509-15.
40. Shen P, Hawksworth J, Lovato J, et al. Cytoreductive surgery
and intraperitoneal hyperthermic chemotherapy with mitomycin C for
peritoneal carcinomatosis from nonappendiceal colorectal carcinoma.
Ann Surg Oncol 2004;11(2):178-86.
41. Vaira M, Cioppa T, D’Amico S, et al. Treatment of peritoneal
carcinomatosis from colonic cancer by cytoreduction, peritonectomy
and hyperthermic intraperitoneal chemotherapy (HIPEC). Experience
of ten years. In Vivo 2010;24(1):79-84.




