
N. SRIFI, M. AIT OURHROUI, B. HASSAM, N. ISMAILI,
Service de dermatologie-vénéréologie, CHU Ibn Sina, Rabat,
Maroc
Les tumeurs malignes du cuir chevelu sont des tumeurs rares. Malgré cette rareté, elles restent d’une grande variabilité histologique. Leur topographie ainsi que leur évolution lente sont à l’origine de difficultés d’ordre diagnostique et thérapeutique. Le but de ce travail est de souligner les particularités épidémiologiques, cliniques, histopathologiques et évolutives de ces tumeurs.
Nous avons cherché à préciser et caractériser les tumeurs malignes du cuir chevelu vues et suivies dans notre service par une étude rétrospective, étalée sur une période de 13 ans. L’étude a inclus tous les patients ayant été hospitalisés entre janvier 1995 et janvier 2009 pour tumeurs primitives malignes, térébrantes ou multiples, et a exclu les patients ayant présenté des lymphomes et des métastases localisées au niveau du cuir chevelu. Au total, 16 patients ont été inclus.
Résultats
Ces patients représentaient 7,5 % des hospitalisations pour tumeurs cutanées durant la même période. Il existe une prédominance masculine avec 10 hommes pour 6 femmes (sex-ratio = 1,6).
L’âge moyen est de 63,3 ans (3996 ans). La durée moyenne d’évolution est variable, allant de 4 mois à 7 ans avec une moyenne de 32,5 mois. La taille moyenne de ces tumeurs est de 6,5 cm avec des extrêmes de 4 et 11 cm. Elles se localisent essentiellement au niveau de la région pariétale, suivie par la région frontale, la région occipitale puis la voûte crânienne. Quatre de nos patients étaient de phototype II, 6 de phototype III, et 6 de phototype IV. Ces patients n’ont jamais été irradiés pour teigne pendant l’enfance. Une alopécie androgénogénétique était présente chez 4 patients. Cliniquement, la moitié des patients présentaient des tumeurs ulcéro-bourgeonnantes, et l’autre moitié des tumeurs nodulaires bourgeonnantes.
Les types histologiques de ces tumeurs étaient dominés par les carcinomes :
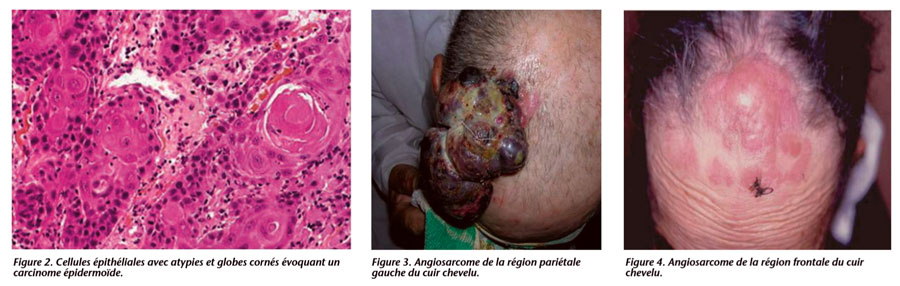
– 9 cas (57 %) de carcinomes épidermoïdes (CE) (figures 1 et 2)
;
– 3 cas (19 %) de carcinomes basocellulaires (CBC).
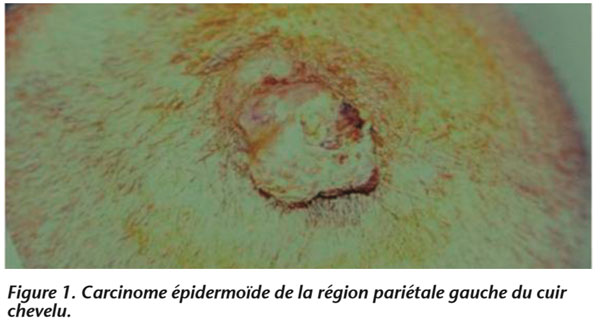
Les autres tumeurs étaient des sarcomes :
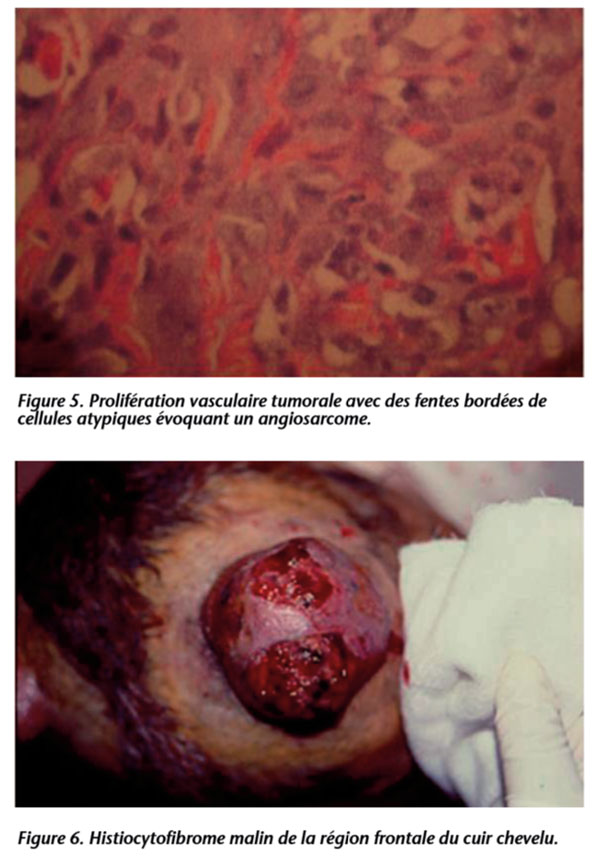
– 2 cas d’angiosarcomes (AS) (figures 3, 4 et 5) ;
– 1 cas de dermatofibrosarcome de Darier et Ferrand (DFS) ;
– 1 cas d’histiocytofibrome malin (HFM) (figure 6).
L’immunohistochimie réalisée chez les 2 patients atteints d’AS a retrouvé un immunomarquage CD34+. Chez la patiente présentant un HFM, celui-ci était négatif ; en revanche, le CD68 était positif. Des métastases étaient présentes chez 7 patients : 6 avec CE et une patiente atteinte d’HFM. Des lésions précancéreuses, type kératose actinique, étaient présentes chez un patient avec CE, plaies traumatiques chez 4 patients (2 CE, 1 HFM, 1 DFS), kyste trichilemmal chez un patient avec CE, et hamartome de Jadassohn chez un patient avec CBC.
Deux associations pathologiques ont été pointées : sclérodermie systémique et angiosarcome chez 2 patients ; adénocarcinome du sein et histiocytofibrome malin chez une patiente. L’exérèse chirurgicale a été préconisée chez 14/16 patients. Les marges d’exérèse étaient saines chez 13 patients. Une cranioplastie a été réalisée dans 2 cas (1 CE et 1 CBC).
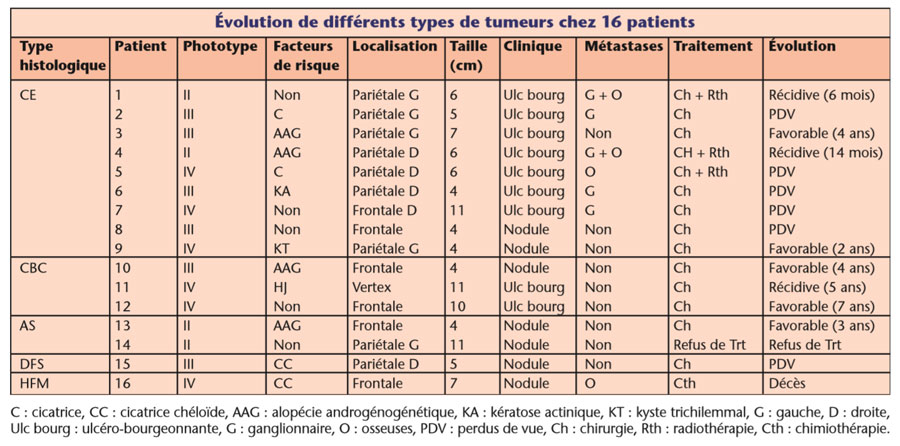
Un traitement par radiothérapie a été pratiqué chez 3 patients atteints de CE qui présentaient des métastases osseuses. Une chimiothérapie palliative a été mise en place chez une patiente atteinte d’HFM. Un des 2 patients présentant un AS avait refusé le traitement. L’évolution a été favorable chez 5 patients (2 CBC, 1 AS, 2 CE) avec un recul moyen de 4 ans. Quatre patients ont présenté des récidives (2 CE, 1 CBC, 1 DFS). Un seul cas de décès a été noté, qui concernait la patiente présentant l’HFM, mais 5 de nos patients ont été perdus de vue (tableau).
Discussion
Dans notre série, ainsi que dans les séries décrites dans la littérature, l’âge de survenue était assez élevé, avec une prédominance masculine (1,2). La localisation au niveau du vertex suivi de la région frontale était la plus fréquemment décrite par certains auteurs(1), chez nos patients, les tumeurs étaient localisées surtout au niveau de la région pariétale, la localisation au niveau du vertex était la moins fréquente. Les lésions précancéreuses retrouvées sont la plaie traumatique, la kératose actinique, le kyste trichilemmal et l’hamartome de Jadassohn. Des auteurs ont rapporté d’autres lésions : radiodermites(3), brûlures thermiques et lupus érythémateux chronique (4). Sur le plan histologique, les tumeurs du cuir chevelu décrites dans la littérature sont par ordre de fréquence les CBC, suivis des CE, des mélanomes puis des sarcomes(2,5,6). Notre série a été marquée par la prédominance des CE et par l’absence de mélanomes ; ceci s’expliquerait par la fréquence de la localisation acrale des mélanomes dans notre contexte. Les mêmes résultats ont été constatés dans une étude taïwanaise dont les auteurs avaient remis en question le rôle des facteurs génétiques, en démontrant une différence épidémiologique entre les patients taïwanais et des patients indiens appartenant à la même race (1). L’association d’un angiosarcome du cuir chevelu à une sclérodermie systémique a été décrite deux fois(7,8) ; ceci serait dû au rôle du Vascular Endothelial Growth Factor (VEGF) dans l’angiocarcinogenèse cutanée. L’expression de celui-ci est élevée chez les patients atteints de sclérodermie systémique (8). À notre connaissance, l’association de l’histiocytofibrome malin à un adénocarcinome mammaire n’a jamais été décrite dans la littérature. Certains auteurs ont mis en évidence une mutation des exons 4 à 8 du gène suppresseur de tumeur p53 qui serait présente dans les 2 tumeurs (9). Nos patients ont été traités chirurgicalement selon les recommandations internationales en matière de CE et de CBC. Concernant les sarcomes, certains auteurs recommandent pour l’AS une chirurgie suivie d’une radiothérapie (10), une radiothérapie suivie d’une immuno thérapie à base d’interleukine 2, recombinant systémique, transartérielle ou intralésionnelle (11), une chimiothérapie à base de doxorubicine avec de l’interféron alpha en intratumoral (12), ou encore une radiothérapie suivie d’une chimiothérapie à base de docétaxel (13).
Notre patient a bénéficié d’une chirurgie large suivie d’une radiothérapie. Pour le DFS, des auteurs recommandent une chirurgie de Mohs avec inclusion en paraffine (14), mais une chirurgie large avec des marges dépassant 3 cm reste plus facile à réaliser avec de bons résultats (15).
Concernant l’HFM, des auteurs préconisent des injections de méthotrexate associées à une chirurgie large (16), notre patiente a bénéficié d’une chimiothérapie palliative en raison du stade avancé de la maladie. Le pronostic est généralement mauvais en raison des stades avancés liés aux consultations tardives dues à la localisation, et à l’évolution lente de ces tumeurs. Conclusion
Le pronostic des tumeurs malignes graves du cuir chevelu est dominé par la fréquence des métastases liées à un retard de consultation. La prise en charge thérapeutique est lourde, la chirurgie est délabrante. Notre série présente des similitudes cliniques et histologiques avec les données de la littérature et des différences épidémiologiques et pronostiques. La chirurgie constitue la pierre angulaire du traitement, mais la prévention reste indispensable, notamment chez les patients de phototypes clairs ou présentant une alopécie androgénogénétique.
Références
1. Katz TM et al. Analysis of 197 female scalp tumors treated
with Mohs micrographic surgery. J Am Acad Dermatol 2005 ; 52 :
291-4.
2. Chiu CS et al. Malignant cutaneous tumors of the scalp: a study
of dermographic characteristics and histologic distributions of 398
Taiwanese patients. J Am Acad Dermatol 2007 ; 56 : 448-52.
3. Maalej M et al. Radio-induced malignancies of the scalp about 98
patients with 150 lesions and literature review. Cancer Radiother
2004 ; 8 : 81-7.
4.Dieng MTet al. Carcinome épidermoïde sur peau noire : 80 cas. Ann
Dermatol Venereol 2004 ; 131 : 1 055-7.
5. Minor LB, Panje WR. Malignant neoplasms of the scalp. Etiology,
resection, and reconstruction. Otolaryngol Clin North Am 1993 ; 26
: 279-93.
6. Rossi P et al. Histiocytofibrome malin orbito-palpébral. J Fr
Ophtalmol 2002 ; 25 : 1 036-42. 7.Fonder MA, Douglas DK.
Angiosarcoma complicating systemic sclerosis: a case report. Cutis
2008 ; 81 : 462-72.
8.Puizina-Ivi Net al.Angiosarcoma arising in sclerodermatous skin.
Acta Dermatovenerol Alp Panonica Adriat 2005 ; 14 : 20-5.
9.Mayr B et al. Presence of p53 mutations in feline neoplasms. Res
Vet Sci 2000 ; 68 : 63-70.
10. Pawlik TM et al. Cutaneous angiosarcoma of the scalp: a
multidisciplinary approach. Cancer 2003 ; 98 : 1 716-26.
11. Ohguri T et al. Angiosarcoma of the scalp treated with curative
radiotherapy plus recombinant interleukin-2 immunotherapy. Int J
Radiat Oncol Boil Phys 2005 ; 61 : 1 446-53.
12. Bong A et al. Treatment of scalp angiosarcoma by controlled
perfusion of A. carotis externa with pegylated liposomal
doxorubicin and intralesional application of pegylated interferon
alfa. J Am Acad Dermatol 2005 ; 52 : S20-S23.
13. Veliz M et al. Durable response of angiosarcoma of the face and
scalp to docetaxel. Clin Oncol (R Coll Radiol) 2007 ; 19 :
210.
14. Tom WD et al. Dermatofibrosarcoma protuberans of the head and
neck: treatment with Mohs surgery using inverted horizontal
paraffin sections. Laryngoscope 2003 ; 113 : 1 289-93.
15. Stojadinovic A et al. Dermatofibrosarcoma protuberans of head
and neck. Ann Surg Oncol 2000 ; 7 : 696-704.
16. Camacho FM et al. Malignant fibrous histiocytoma of the scalp.
Multidisciplinary treatment. J Eur Acad Dermatol Venereol 1999 ; 13
: 175-82.




