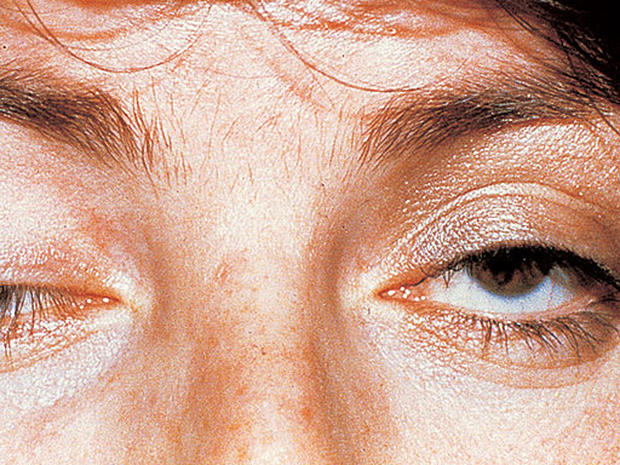
La myasthénie est une maladie neurologique auto- immune liée à la présence d’anticorps dirigés contre la jonction neuromusculaire. Malgré des avancées thérapeutiques notables, certaines formes restent réfractaires, pouvant même menacer le pronostic vital. La prévalence de la myasthénie sévère réfractaire aux différentes approches thérapeutiques est d’environ 10 %. Elle est plus souvent rapportée chez la femme et en cas de positivité des anticorps musculaires spécifique kinase. Une thymectomie est souvent pratiquée, avec amélioration, en règle générale, partielle. La perfusion mensuelle de cyclophosphamide ou l’administration d’une forte dose a pu, chez certains malades, entraîner un bénéfice, mais exceptionnellement une rémission complète. L’apport de rituximab a donné, dans des études observationnelles rétrospectives, un taux de rémission compris entre 12 et 78 % pour un suivi allant de 18 à 39 mois. L’éculizumab apporterait également un gain net en termes de qualité de vie. Quant à la place de la greffe de moelle hétérologue, elle est très limitée en raison d’une mortalité pouvant culminer jusqu’ à 38 % et par le fait qu’elle peut induire une myasthénie secondaire, manifestation rare de la maladie du greffon contre l’hôte.
La greffe de cellules souches hématopoïétiques autologues (HSCT) est utilisée dans plusieurs maladies neurologiques auto-immunes dont la sclérose en plaques, les polyneuropathies démyélinisantes chroniques, la neuromyélite ou encore le syndrome de l’homme raide.
A. Bryant et coll. rapportent une série rétrospective de 7 patients atteints d’une forme sévère de myasthénie et traités par HSCT. Il a s’agit d’un travail monocentrique, réalisé à l’hôpital d’Ottawa (Canada), qui est un centre hospitalier tertiaire, compétent tant dans la prise en charge des myasthénies que dans la pratique des greffes de moelle. Il a été conduit entre le 1er janvier 2001 et le 31 décembre 2014 et a inclus tous les patients myasthéniques ayant reçu une HSCT. Le critère primaire d’appréciation a été l’évolutivité de la maladie post greffe, appréciée par la fréquence des consultations d’urgence et des réhospitalisations, la classification clinique, l’état du patient et les traitements post transplantation, selon la classification de la Myasthenia Gravis Foundation of America (MGFA). L’étude a porté également sur les complications graves, de grade III ou plus, survenues après greffe.
L’âge moyen de ces 7 patients lors du diagnostic était de 37+/-11 ans et celui lors de l’HSCT de 44+/-10 ans. Un des patients était porteur d’un lymphome folliculaire. Cinq (71 %) avaient des signes témoignant d’une dysrégulation auto-immune. Tous présentaient des signes cliniques et electromyographiques caractéristiques de myasthénie. Deux sur étaient séronégatifs pour les anticorps anti-récepteurs à l’acétylcholine, les anticorps musculaires spécifique- kinase n’ayant pas été dosés dans cette série. En prégreffe, selon la classification MGFA, la sévérité de la myasthénie allait du grade III au grade V, avec mise en jeu du pronostic vital. La maladie était réfractaire aux différents traitements, dont la pyridostigmine, les corticoïdes, les immunomodulateurs, les échanges plasmatiques ou l’apport d’immunoglobulines intraveineuses. 4 des patients, non porteurs de thymome, avaient, en outre, été thymectomisés. Six malades avaient nécessité au moins une consultation d’urgence et/ou une hospitalisation, 3 un séjour en soins intensifs et 2 avaient été intubés.
De façon habituelle, le protocole de greffe a comporté, dans un premier temps, la mobilisation des cellules souches par cyclophosphamide et facteurs de croissance granulocytaires, puis un recueil par leucophérèse du sang périphérique avec purge lymphocytaire par anti-CD34. Dans un second temps, les patients ont subi un conditionnement par chimiothérapie intensive visant à détruire leur système immunitaire autoréactif (associé ou non à une irradiation corporelle totale), suivi de la réinjection des cellules souches prélevées en vue de la reconstitution d’un système immunitaire protecteur et autotolérant.
Des résultats constants et durables
La médiane de suivi a été de 40 mois (29 à 149 mois). Une rémission complète, selon la classification MGFA, est survenue chez tous les malades, sans symptomatologie résiduelle. Huit mois après la greffe, aucun ne continuait à prendre de traitement immunosuppresseur ; 6 avaient arrêté toute médication anti-myasthénique et un seul a continué à être traité par de faibles doses de pyridostigmine. Un des malades a nécessité une nouvelle hospitalisation, non pour poussée myasthénique, mais pour troubles ventilatoires post-intubation prolongée. La durée d’hospitalisation pour greffe a été, en moyenne, de 30 jours (13 à 43) avec survenue de 2 cas de mucite grave et de 3 cas de neutropénie fébrile. Au 11e jour suivant la greffe, le nombre moyen de neutrophiles était 500/µL. Aucun décès n’a été déploré, mais, dans les 2 mois suivant, 3 épisodes de réactivation virale se sont déclarés, tous résolutifs sous traitement et, à 2ans, un des patients a développé une thrombocytopénie amégacaryocytaire. Quant au malade porteur d’un lymphome concomitant, il a récidivé dans les 12 mois suivant l’HSCT avec décès au 17e mois post-greffe alors que la myasthénie était en rémission complète.
Au total, l’HSCT autologue apparaît, dans cette petite série, donner des résultats constants (7 succès sur 7), complets (rémission totale) et durables (pour un suivi de 29 à 129 mois), sans nécessité du maintien d’un traitement immunosuppresseur à long terme. On doit toutefois rappeler qu’il s’agit d’une étude rétrospective d’un travail monocentrique, de faible échelle, dans laquelle les patients n’avaient pas été traités en prégreffe, par des thérapeutiques nouvelles comme le rituximab ou l’éculizumab, voire par une corticothérapie à des doses supérieures à 60 mg/j. En l’absence d’éléments de comparaison probants, le recours à l’HSCT ne peut être envisagé que au cas par cas, en mettant en balance une possible rémission complète avec les risques et le coût de cette technique.
L’HSCT nécessite une hospitalisation parfois de longue durée ; elle peut entraîner des complications graves telles que des infections opportunistes ou des atteintes organiques. A long terme, elle peut être responsable de troubles endocriniens, comme par exemple une insuffisance gonadique ou une hypothyroïdie. De plus, la dysfonction de la régulation immunitaire peut être la cause de réactivations virales, tumeurs malignes secondaires et maladies auto immunes induites.
A ce jour, l’HSCT doit donc rester l’affaire de centres hautement spécialisés, avec une grande expérience tant dans le domaine de la prise en charge des myasthénie sévères que dans celui des HSCT, dans l’attente de travaux prospectifs complémentaires.
En conclusion, l’HSCT autologue a fait la démonstration de son efficacité dans nombre de maladies auto immunes réfractaires, dont des maladies neurologiques. Elle pourrait être utile dans la prise en charge des formes sévères de myasthénie, menaçant le pronostic vital mais, à ce jour, sa place exacte dans l’arsenal thérapeutique nécessite de nouvelles études.
Dr Pierre Margent




